题目内容
8.下列叙述正确的是( )| A. | 用标准的盐酸溶液滴定含甲基橙的氢氧化钠溶液,终点时溶液由黄色变成橙色 | |
| B. | 将二氧化硫通入氯化钡溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失 | |
| C. | 向葡萄糖溶液中加入新制氢氧化铜,加热至沸腾,静置后上层溶液呈红色 | |
| D. | 海水提取溴的过程不发生氧化还原反应 |
分析 A.甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,3.1-~4.4的呈橙色;
B.二氧化硫通入氯化钡溶液中,弱酸不能制强酸,不反应;
C.新制氢氧化铜中加入葡萄糖溶液反应生成红色沉淀;
D.溴离子变为溴单质为氧化还原反应;
解答 解:A.甲基橙的变色范围3.1~4.4,大于4.4为黄色,而盐酸滴定氢氧化钠时是由碱性到中性,PH大于4.4为黄色,3.1-~4.4的呈橙色,终点时溶液由黄色变成橙色,故A正确;
B.二氧化硫通入氯化钡溶液中,弱酸不能制强酸,不反应,加入稀硝酸后,硝酸氧化亚硫酸,生成不溶于硝酸的硫酸钡,产生白色沉淀,故B错误;
C.新制氢氧化铜中加入葡萄糖溶液加热反应生成红色沉淀,静置后上层溶液呈无色,故C错误;
D.溴离子失电子发生氧化反应而生成溴单质,所以发生了氧化还原反应,故D错误;
故选A.
点评 本题考查指示剂、二氧化硫的性质、葡萄糖的性质以及海水提取溴单质等,题目难度不大,注意甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,3.1-~4.4的呈橙色.

练习册系列答案
相关题目
18.雷雨天闪电时空气中有臭氧(O3)生成,下列说法正确的是( )
| A. | O2和O3互为同位素 | |
| B. | 在相同的温度与压强下,等体积的O2和O3含有相同的分子数 | |
| C. | 等物质的量的O2和O3含有相同的质子数 | |
| D. | O2和O3的相互转化是物理变化 |
19. 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
3.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 标准状况下,22.4L37Cl2中所含中子数为40NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-数目为0.2NA |
13.人的血液里Ca2+的浓度一般采用g•cm-3表示,今抽一血样20.00mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀洗净后溶于强酸可得草酸,再用浓度为0.02mol•L-1的KMnO4溶液滴定.当观察到溶液紫色褪尽时,共消耗12.00mL KMnO4溶液.则该血液样品中Ca2+的浓度为( )
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
20.下列关于物质性质变化的比较,不正确的是( )
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
18.有A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中正确的是( )
| A. | A和B一定是同分异构体 | |
| B. | A和B不可能是同系物 | |
| C. | A和B的最简式相同 | |
| D. | A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等 |
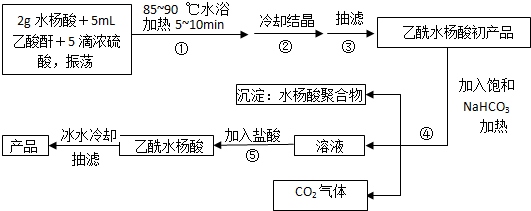
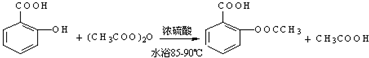 ;反应类型取代反应;
;反应类型取代反应; 、
、 ;
; ;
;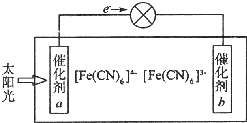 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.