题目内容
11.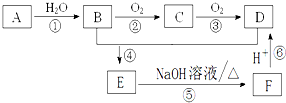 已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:
已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:(1)写出A的结构简式CH2=CH2.
(2)写出下列反应的反应类型:①加成反应,④酯化反应或取代反应
(3)写出下列反应的化学方程式:
①CH2=CH2+H2O$\stackrel{催化剂}{→}$C2H5OH;②2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;③2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH; ⑤CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
分析 A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,A和水发生加成反应生成B,B为CH3CH2OH,B发生氧化反应生成C,C为CH3CHO,C发生氧化反应生成D,D常用作厨房中的调味品,则D为CH3COOH,乙醇和乙酸发生酯化反应生成E,E为CH3COOCH2CH3,E在碱性条件下水解生成F,F酸化得到D,则F为CH3COONa,据此分析解答.
解答 解:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,A和水发生加成反应生成B,B为CH3CH2OH,B发生氧化反应生成C,C为CH3CHO,C发生氧化反应生成D,D常用作厨房中的调味品,则D为CH3COOH,乙醇和乙酸发生酯化反应生成E,E为CH3COOCH2CH3,E在碱性条件下水解生成F,F酸化得到D,则F为CH3COONa,
(1)通过以上分析知,A为CH2=CH2,
故答案为:CH2=CH2;
(2)反应的反类型:①为加成反应,④为酯化反应或取代反应,
故答案为:加成反应;酯化反应或取代反应;
(3)①为乙烯与水的加成反应,反应方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$C2H5OH,
②为乙醇的催化氧化反应,反应方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
③为乙醛的催化氧化,反应的方程式为2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH,
⑤为酯的水解反应,反应方程式为 CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$C2H5OH;2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
点评 本题考查有机物推断,为高频考点,涉及烯烃、醇、醛、羧酸、酯之间的转化,明确常见反应类型、反应条件、官能团及其性质关系等即可解答,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| 选项 | 实验操作及现象 | 实验目的 |
| A | 溶液中滴加盐酸酸化的氯化钡溶液出现白色沉淀 | 检验溶液中存在SO42- |
| B | FeBr2溶液加入少量氯水,溶液有浅绿色变为黄色 | 比较Fe2+、Br-还原性强弱 |
| C | 向一定浓度Na2SiO3溶液中通CO2,溶液变浑浊 | 比较C、Si非金属性强弱 |
| D | 溶液中加KSCN溶液,再加氯水,观察溶液是否出现血红色 | 检验Fe3+溶液中是否含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 丙烷、丙烯都属于烃,都有同分异构体 | |
| C. | 葡萄糖可转化为乙醇,乙醇氧化可得到乙醛 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
| A. | 汽油 | B. | 色拉油 | C. | 甘油 | D. | 煤油 |
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 标准状况下,22.4L37Cl2中所含中子数为40NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-数目为0.2NA |
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |

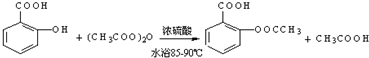 ;反应类型取代反应;
;反应类型取代反应;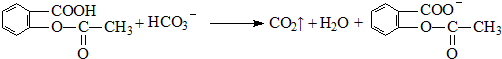 、
、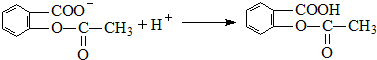 ;
;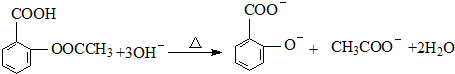 ;
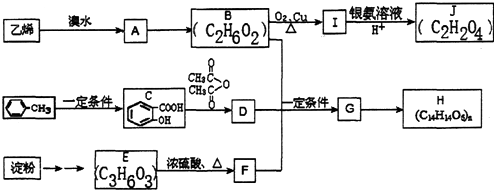
;
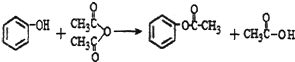
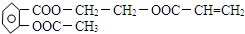 .
.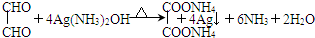
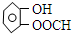 (或间、对位)
(或间、对位)