题目内容
13.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 0.1 mol•L-1的(NH4)2SO4溶液中含有阳离子的总数为0.2NA | |
| C. | 7.8 g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、溶液体积不明确;
C、硫化钠和过氧化钠的摩尔质量都是78g/mol,过氧化钠中的阴离子为过氧根离子;
D、氯气与氢氧化钠的反应为歧化反应.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L乙烯的物质的量小于0.1mol,故含有的C-H键的物质的量小于0.4mol,故A错误;
B、溶液体积不明确,故溶液中阳离子的个数不能计算,故B错误;
C、7.8g硫化钠和7.8g过氧化钠的物质的量均为0.1mol,0.1mol硫化钠、过氧化钠中都含有0.1mol阴离子,含有的阴离子数目均为0.1NA,故C正确;
D、标况下,2.24L氯气的物质的量为0.1mol,而氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,故0.1mol氯气转移0.1mol电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 一种烃在足量的氧气中燃烧并通过碱石灰减少的体积就是生成水蒸气的体积 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积改变(温度25℃),若体积减少,则y>4,否则y<4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高 |
8.1mol乙烷在光照条件下,最多可以与多少摩尔的Cl2发生取代反应( )
| A. | 4mol | B. | 8mol | C. | 2mol | D. | 6mol |
18.有下列结论中正确的是( )
①微粒半径:Cl>S>P
②氢化物的稳定性:HF>HCl>HBr
③离子的还原性:Cl->Br->I-
④氧化性:S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>Br.
①微粒半径:Cl>S>P
②氢化物的稳定性:HF>HCl>HBr
③离子的还原性:Cl->Br->I-
④氧化性:S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>Br.
| A. | ②④⑥ | B. | ①③④ | C. | ①②⑤ | D. | ②⑤⑥ |
5.某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 不能氧化成醛 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
2.写出下列基团的名称:
| -C═C- | ─C≡C─ | ─CH3 | ─CH2CH3或─C2H5 |
| 双键 | 三键 | 甲基 | 乙基 |
| ─OH | -COO-R | ─CHO | ─COOH |
| 羟基 | 醛基 | 酯基 | 羧基 |
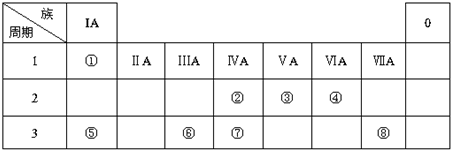
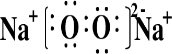 .
.
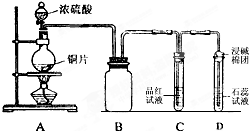 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.