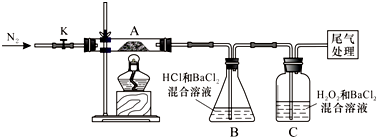
题目内容
19.下列物质分类正确的是( )| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | HD、HCHO都是极性分子 | D. | 干冰、可燃冰都是分子晶体 |
分析 A、和碱反应生成盐和水的氧化物为酸性氧化物;
B、水银为金属汞;
C、HD为氢气分子;
D、干冰是二氧化碳固体,可燃冰是甲烷晶体.
解答 解:A、和碱反应生成盐和水的氧化物为酸性氧化物,NO2和碱反应发生的是氧化还原反应,不是酸性氧化物,Cl2O7是酸性氧化物,故A错误;
B、水银为金属汞,属于纯净物,水玻璃是硅酸钠的水溶液,属于混合物,故B错误;
C、HD为氢气分子,是非极性分子,HCHO是极性分子,故C错误;
D、干冰是二氧化碳固体,可燃冰是甲烷晶体,都是分子晶体,故D正确;
故选D.
点评 本题考查了物质分类方法和物质组成的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
9.下列选项属于碳链异构的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2═C(CH3)2和CH3CH═CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2CH2COOH和CH3COOCH2CH3 |
7. 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,A的电负性>B的电负性(填“>”、“<”或“=”);
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中主要化学键C-C、C-N、C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2、sp3;
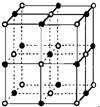
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl;
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个;
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部).[LiC60]PF6晶体中包含的化学键有BCD(填字母);
A.金属键 B.离子键 C.极性键 D.非极性键 E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为$\frac{3488}{(a×1{0}^{-7})^{3}{N}_{A}}$g/cm3(用含a、NA的式子表示).
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中主要化学键C-C、C-N、C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2、sp3;
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个;
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部).[LiC60]PF6晶体中包含的化学键有BCD(填字母);
A.金属键 B.离子键 C.极性键 D.非极性键 E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为$\frac{3488}{(a×1{0}^{-7})^{3}{N}_{A}}$g/cm3(用含a、NA的式子表示).
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| B. | 17.4 g某硫化磷(如图)中含P-S键数目为0.6NA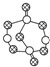 | |
| C. | 1 mol含8个碳原子的某烃分子,最多形成7 mol碳碳单键 | |
| D. | 标准状况下,22.4 L SO2与O2混合气体,含有2NA个氧原子 |
11.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E单质从HE的溶液中置换出来 | |
| B. | A、H、J的离子半径由大到小顺序是A>J>H | |
| C. | G元素的单质不存在同素异形体 | |
| D. | I在DB2中燃烧生成两种化合物 |
8.1mol乙烷在光照条件下,最多可以与多少摩尔的Cl2发生取代反应( )
| A. | 4mol | B. | 8mol | C. | 2mol | D. | 6mol |