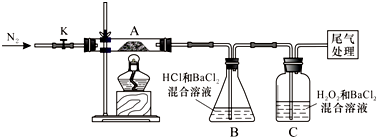
题目内容
16.PVC管材具有耐腐蚀、重量轻、耐高压等优点,是当今世界上产量最大、应用最广的热塑性塑料之一.它是聚氯乙烯的简称,下列关于PVC说法正确的是( )| A. | PVC的单体是CH3CH2Cl | |
| B. | PVC是高分子化合物 | |
| C. | PVC能够使溴的四氯化碳溶液褪色 | |
| D. | PVC保鲜膜最适合用来包装蔬菜、水果及熟食 |
分析 A.聚氯乙烯的单体是氯乙烯;
B.聚氯乙烯中相对分子质量很大,属于高分子化合物;
C.聚氯乙烯中不含碳碳不饱和键;
D.聚氯乙烯在高温下易分解出有毒物质.
解答 解:A.聚氯乙烯的单体是CH2=CHCl,故A错误;
B.聚氯乙烯中相对分子质量在1万以上,属于合成高分子化合物,故B正确;
C.聚氯乙烯中不含碳碳不饱和键,所以不能和溴发生加成反应,故C错误;
D.聚氯乙烯在高温下易分解出有毒物质,所以不能用来包装蔬菜、水果及熟食,故D错误;
故选B.
点评 本题以聚氯乙烯为载体考查化学与生活、有机物的结构和性质,明确官能团和性质的关系即可解答,难点是根据高分子化合物结构简式确定其单体,题目难度不大.

练习册系列答案
相关题目
6.用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
7. 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,A的电负性>B的电负性(填“>”、“<”或“=”);
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中主要化学键C-C、C-N、C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2、sp3;
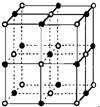
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl;
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个;
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部).[LiC60]PF6晶体中包含的化学键有BCD(填字母);
A.金属键 B.离子键 C.极性键 D.非极性键 E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为$\frac{3488}{(a×1{0}^{-7})^{3}{N}_{A}}$g/cm3(用含a、NA的式子表示).
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中主要化学键C-C、C-N、C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2、sp3;
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个;
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部).[LiC60]PF6晶体中包含的化学键有BCD(填字母);
A.金属键 B.离子键 C.极性键 D.非极性键 E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为$\frac{3488}{(a×1{0}^{-7})^{3}{N}_{A}}$g/cm3(用含a、NA的式子表示).
11.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E单质从HE的溶液中置换出来 | |
| B. | A、H、J的离子半径由大到小顺序是A>J>H | |
| C. | G元素的单质不存在同素异形体 | |
| D. | I在DB2中燃烧生成两种化合物 |
1.下列说法正确的是( )
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 一种烃在足量的氧气中燃烧并通过碱石灰减少的体积就是生成水蒸气的体积 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积改变(温度25℃),若体积减少,则y>4,否则y<4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高 |
8.1mol乙烷在光照条件下,最多可以与多少摩尔的Cl2发生取代反应( )
| A. | 4mol | B. | 8mol | C. | 2mol | D. | 6mol |
5.某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 不能氧化成醛 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
6.质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是( )
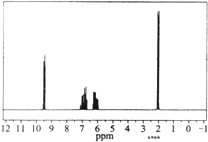

| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |