题目内容
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
| A.盐酸的浓度 | B.铝条的表面积 | C.溶液的温度 | D.加少量Na2SO4固体 |
D
解析试题分析:影响化学反应速率的因素有,温度,浓度,压强,催化剂,固体反应物的接触面积。因此答案选D
考点:考查影响化学反应速率因素的相关知识点

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
80℃时,2L密闭容器中充入0.40molN2O4,发生反应
N2O4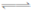 2NO2
2NO2 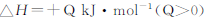 ,获得如下数据:
,获得如下数据: 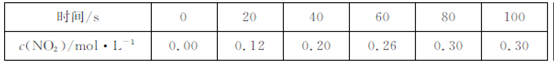 下列判断正确的是
下列判断正确的是
| A.升高温度该反应的平衡常数K减小 |
B.20~40s内,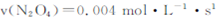 |
| C.反应达平衡时,吸收的热量为0.30QkJ |
| D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大 |
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等。下列有关说法不正确的是
| A.其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡 |
| B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D.加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大 |
已知:N2(g)+3H2(g) 2NH3(g);△H="-92.4" kJ/mol,下列结论正确的是
2NH3(g);△H="-92.4" kJ/mol,下列结论正确的是
| A.在密闭容器中加入1 molN2(g)和3 molH2(g)充分反应放热92.4 kJ |
B.N2(g)+3H2(g) 2NH3(l);△H="-Q" kJ/mol,则Q>92.4 2NH3(l);△H="-Q" kJ/mol,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
下列叙述错误的是
| A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C.用碳酸钙粉末替代碳酸钙块状固体与盐酸反应,可以加快反应速率 |
| D.用AgNO3溶液可以鉴别KC1和KI |
某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s内B的反应速率为
A.0.05mol/(L s) s) | B.0.05 | C.0.5mol/(L s) s) | D.0.05mol/L |
 CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )