题目内容
下列叙述错误的是
| A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C.用碳酸钙粉末替代碳酸钙块状固体与盐酸反应,可以加快反应速率 |
| D.用AgNO3溶液可以鉴别KC1和KI |
A
解析试题分析:A、SO2使溴水褪色与乙烯使KMnO4溶液褪色均发生的是氧化还原反应,正确;B、乙酸乙酯在NaOH溶液中水解较为彻底,错误;C、用碳酸钙粉末替代碳酸钙块状固体与盐酸反应,增大了反应物的接触面积,可以加快反应速率,正确;D、用AgNO3溶液分别与KCl和KI反应产生白色、黄色沉淀,可以鉴别KC1和KI,正确。
考点:考查化学反应原理分析、评价。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下面关于化学反应的限度的叙述中,正确的是
| A.化学反应的限度都相同 |
| B.可以通过改变温度控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应的限度 |
| D.当一个化学反应在一定条件下达到限度时,反应即停止 |
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
| A.盐酸的浓度 | B.铝条的表面积 | C.溶液的温度 | D.加少量Na2SO4固体 |
在密闭容器中,存在反应: ,下列可使化学反应速率增大的措施是( )
,下列可使化学反应速率增大的措施是( )
A.减小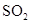 浓度 浓度 | B.升高温度 | C.增大容器体积 | D.降低温度 |
体积相同的甲、乙两个容器中,分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法比较 |
已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化 |
(原创)下图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况。达到平衡后,改变压强,平衡不移动。下列说法中正确的是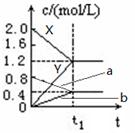
| A.Z物质的变化情况为曲线b |
B.该反应的化学方程式为:2X(g) 3Y(g) + Z(g) 3Y(g) + Z(g) |
| C.0→t1,X的物质的量浓度变化量为1.2mol/L |
| D.若t1= 1min,则v(Y )=" 0.02" mol·L-1·s-1 |

