题目内容
一定温度下,某密闭容器里发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
①升高温度 ②增大压强
③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
| A.①② | B.②④ | C.③④ | D.①②③ |
B
解析试题分析:①升高温度,平衡正向移动,但是平衡移动的趋势是微弱的,不足以使物质的浓度增大一倍,错误;②由于该反应是反应前后气体体积相等的反应,若增大压强酯原来的二倍,由于平衡不移动,单位体积内的气体的物质的量都是原来的2倍,故可以符合题意,正确;③再通入n mol CO2和n mol H2,平衡逆向移动,当达到平衡时,H2的物质的量浓度不会增大1倍,错误;④再加入2n mol CO和2n mol H2O(g),由于物质的量是原来的2倍,增大反应物的浓度,平衡不反应移动,所以使H2的物质的量浓度增大1倍。正确。
考点:考查改变物质浓度的方法的知识。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
| A.盐酸的浓度 | B.铝条的表面积 | C.溶液的温度 | D.加少量Na2SO4固体 |
体积相同的甲、乙两个容器中,分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法比较 |
已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化 |
下列平衡常数中,表示的正反应程度最大的是
A.K=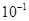 | B.K=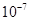 | C.K=1 | D.K=1010 |
(原创)下图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况。达到平衡后,改变压强,平衡不移动。下列说法中正确的是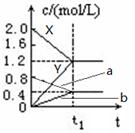
| A.Z物质的变化情况为曲线b |
B.该反应的化学方程式为:2X(g)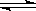 3Y(g) + Z(g) 3Y(g) + Z(g) |
| C.0→t1,X的物质的量浓度变化量为1.2mol/L |
| D.若t1= 1min,则v(Y )=" 0.02" mol·L-1·s-1 |
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1 s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
| A.t1>t2 | B.t1<t2 | C.t1=t2 | D.不能肯定 |
在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应
A(g) + 2B(g) C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.反应放出的热量 |
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1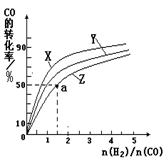
 O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1