题目内容
20.下列说法正确的是( )| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
分析 A、降低温度,平衡朝着吸热反应方向移动;
B、定容时俯视刻度线,导致所配溶液的体积偏小,结合c=$\frac{n}{V}$判断;
C、锥形瓶无需干燥;
D、渗析、过滤都利用微粒直径大小,据此解答即可.
解答 解:A、降低温度,平衡朝着吸热反应方向移动,氯化钴溶液置于冰水浴,溶液变成粉红色,故此反应逆反应为吸热,那么正反应为放热,故a<0,故A错误;
B、定容时俯视刻度线,导致所配溶液的体积偏小,结合c=$\frac{n}{V}$可知,所配溶液的浓度偏大,故B错误;
C、锥形瓶无论是否干燥,对实验结果都没有影响,故C错误;
D、胶体粒子直径比半透膜小,可用渗析方法分离,浊液粒子不能透过滤纸,可用过滤的方法分离,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的分离、平衡移动原理、中和滴定实验等知识,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.温度为25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有 WgNa2SO4•10H2O析出,若温度不变,此时剩余溶液中的溶质的质量分数为( )
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | ||
| C. | $\frac{7100W}{161(W+18a)}$×100% | D. | $\frac{7100W}{161(W+36a)}$×100% |
11.目前人类已发现的非金属元素除稀有气体外,共有16种,对这16种非金属元素的相关判断:
①都是主族元素,最外层电子数都大于4;
②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态;
④氧化物常温下都可以与水反应生成酸.其中不正确的有( )
①都是主族元素,最外层电子数都大于4;
②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态;
④氧化物常温下都可以与水反应生成酸.其中不正确的有( )
| A. | 只有①② | B. | 只有①③ | C. | 只有③④ | D. | ①②③④ |
8.下列叙述正确的是( )
| A. | 将CO2通往入溶有少量氨的BaCl2溶液中,无白色沉淀生成 | |
| B. | 常温下,稀释0.1mol/L的醋酸,溶液中所有离子浓度均下降 | |
| C. | 等体积等浓度的CH3COOH与NaOH溶液混合后,溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
15.锌溴液流电流是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,其在电解质储罐和电池间不断循环.下列说法不正确的是( )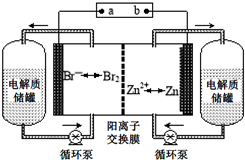

| A. | 放电时负极的电极反应式为Zn-2e-=Zn2+ | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
5.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
12.生活中处处有化学,下列表述不正确的是( )
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 碳酸氢钠可作胃酸的中和剂 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
9.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法不正确的是(
| A. | 原子半径Z>W>R | |
| B. | W与X、W与Z形成的化学键类型完全相同 | |
| C. | 对应的氢化物的热稳定性:R>W | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
10.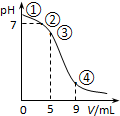 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol•L-1 | |
| C. | 点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |