题目内容
5.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
分析 X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,据此解答.
解答 解:X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl.
A.X、M两种元素形成的化合物可以是Na2O或Na2O2,故A错误;
B.氯气、臭氧可作为水处理中的消毒剂,故B正确;
C.元素Y、Z、W的单质分别属于原子晶体、分子晶体、分子晶体,故C错误;
D.由于W、Z、M元素的氢化物分别为HCl、硫化氢、水,由于水分子之间有氢键的存在,所以水的沸点最高,HCl与硫化氢中HCl相对分子质量较大,分子间注意力较强,HCl沸点高于硫化氢,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,解题的关键在于元素的推断,注意D选项中氢键对物质性质的影响,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列方法或操作正确且能达到预期目的是( )
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
16.能证明乙醇分子中含有一个羟基的事实是( )
| A. | 乙醇完全燃烧生成水 | |
| B. | 乙醇容易挥发 | |
| C. | 乙醇能与水以任意比例互溶 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
13.短周期元素X、Y、Z、W的原子序数依次增大,X、Y、Z的原子序数之和是W的2倍,X、Z在周期表中的相对物质如图所示,X的最低负价绝对值与其原子的最外层电子数相等.下列说法正确的是( )
| X | |||
| Z |
| A. | 离子半径:r(Y)>r(Z)>r(W) | |
| B. | Z的简单离子能破坏水的电离平衡 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z的简单气态氢化物的热稳定性比W的强 |
20.下列说法正确的是( )
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
10.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液显碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等.则下列说法正确的是( )
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
14.下列说法不正确的是( )
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 有机硅聚醚(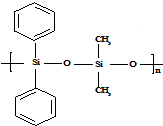 )可由单体 )可由单体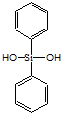 和 和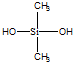 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
15.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的正戊烷所含的分子数为0.5NA | |
| B. | 1 mol甲基中的电子数目为9NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为NA |



