题目内容
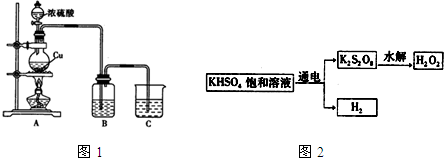
10.温度为25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有 WgNa2SO4•10H2O析出,若温度不变,此时剩余溶液中的溶质的质量分数为( )| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | ||
| C. | $\frac{7100W}{161(W+18a)}$×100% | D. | $\frac{7100W}{161(W+36a)}$×100% |
分析 用铂作电极,电解饱和硫酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,实际上是电解的水,发生总反应2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,根据质量分数公式计算即可.
解答 解:用Pt作电极,电解饱和硫酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,
w g Na2SO4•10H2O硫酸钠的质量=wg×$\frac{142}{322}$=$\frac{71W}{161}$g,
设电解水的质量为x:
2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑
36g 2mol
x amol
x=18ag
所以饱和溶液的质量分数=$\frac{\frac{71W}{161}g}{(W+18a)g}$×100%=$\frac{7100W}{161(W+18a)}$%,
故选C.
点评 本题以电解原理为载体,考查溶液质量分数的计算,判断电解析出的晶体和消耗的水构成的溶液仍为饱和溶液是解题的关键,难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
2.下列有机物中,既能发生加成、酯化反应,又能发生氧化反应的是( )
①CH2(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CHCH2OH ④CH2=CHCOCHO ⑤CH2=CHCOOH.
①CH2(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CHCH2OH ④CH2=CHCOCHO ⑤CH2=CHCOOH.
| A. | ③⑤ | B. | ①③⑤ | C. | ②④ | D. | ①③ |
18.下列关于有机化合物的说法正确的是( )
| A. | 乙醇和乙酸均能与钠反应生成氢气 | |
| B. | 煤的干馏、油脂的皂化和石油的分馏都属于化学变化 | |
| C. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 | |
| D. | 糖类、油脂、蛋白质均属于高分子化合物 |
5.以下实验或操作不能达到目的是( )
| A. | 用溴水鉴别苯、乙醇、四氯化碳 | |
| B. | 准确称取4.0 gNaOH溶于9 6 mL水得质量分数为4.0%的溶液 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| D. | 用激光笔检验淀粉溶液的丁达尔现象 |
15.下列方法或操作正确且能达到预期目的是( )
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
19.下列有关非金属单质的说法正确的是( )
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
| A. | ①②③⑤⑥ | B. | ②③⑥⑦ | C. | ①②③④⑦ | D. | ①②④⑥ |
20.下列说法正确的是( )
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.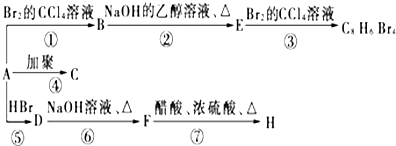

 ,D
,D ,E
,E ,F
,F .
.