题目内容
15.锌溴液流电流是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,其在电解质储罐和电池间不断循环.下列说法不正确的是( )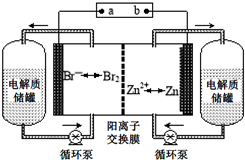
| A. | 放电时负极的电极反应式为Zn-2e-=Zn2+ | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
分析 A.放电时,Zn易失电子发生氧化反应,则b是负极,溴得电子发生还原反应,则a是正极;
B.充电时,电解池阳极连接电源正极;
C.阳离子交换膜只能阳离子通过;
D.放电时,阳离子向正极移动,正极上溴得电子生成溴离子.
解答 解:A.放电时,Zn易失电子发生氧化反应,则b是负极,溴得电子发生还原反应,则a是正极,负极反应式为Zn-2e-=Zn2+,故A正确;
B.充电时,电解池阳极连接电源正极,充电时a电极上失电子发生氧化反应而作阳极,应该连接电源正极,故B错误;
C.阳离子交换膜只能阳离子通过,分子或阴离子不能通过,所以阳离子交换膜可阻止Br2与Zn直接发生反应,故C正确;
D.放电时,阳离子向正极移动,正极上溴得电子生成溴离子,所以放电时左侧电解质储罐中的离子总浓度增大,故D正确;
故选B.
点评 本题考查化学电源新型电池,明确各个电极上发生的反应及离子交换膜的作用即可解答,难点是电极反应式的书写,知道电解质溶液中离子移动方向,题目难度不大.

练习册系列答案
相关题目
5.以下实验或操作不能达到目的是( )
| A. | 用溴水鉴别苯、乙醇、四氯化碳 | |
| B. | 准确称取4.0 gNaOH溶于9 6 mL水得质量分数为4.0%的溶液 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| D. | 用激光笔检验淀粉溶液的丁达尔现象 |
6.下列实验装置或操作正确的是( )
| A. |  将海带灼烧成灰 | B. |  除去氯气中的HCl | C. |  实验室制取NO | D. |  配制溶液过程 |
3.下列反应的离子方程式书写正确的是( )
| A. | Fe3O4溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | Fe3+和CO32-不能共存是因为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向NH4HCO3溶液中加入足量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
10.单斜硫和正交硫转化为二氧化硫的能量变化图如所示.下列说法正确的是( )
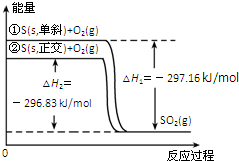

| A. | S(s,单斜)═S(s,正交)△H=+0.33kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫燃烧的热化学方程式为:S(s,单斜)+O2(g)═SO2(g)△H=-296.83kJ•mol-1 | |
| D. | ①式表示断裂1 molO2中的共价键所吸收的能量比形成1 molSO2 中的共价键所放出的能量少297.16kJ |
20.下列说法正确的是( )
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
4.下列标志的高分子材料的单体,其中一种单体与其他三种单体均不是同系物的是( )
| A. |  HDPE高密度乙烯 | B. |  LDPE低密度乙烯 | C. |  DPP聚丙烯 | D. |  PS聚苯乙烯 |
5.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,2.24 L H2O中含有极性共价键的数目为0.2 NA | |
| B. | 0.1 mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
 ,G在元素周期表中的位置为第三周期第ⅤⅡA族.
,G在元素周期表中的位置为第三周期第ⅤⅡA族.