题目内容
8.下列叙述正确的是( )| A. | 将CO2通往入溶有少量氨的BaCl2溶液中,无白色沉淀生成 | |
| B. | 常温下,稀释0.1mol/L的醋酸,溶液中所有离子浓度均下降 | |
| C. | 等体积等浓度的CH3COOH与NaOH溶液混合后,溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
分析 A.氯化钡溶液与二氧化碳不发生反应,所以不会生成白色沉淀;
B.稀释过程中水的离子积不变,应用氢离子浓度减小,则氢氧根离子浓度增大;
C.二者恰好反应生成醋酸钠,根据醋酸钠溶液中电荷守恒、盐的水解原理判断各离子浓度大小;
D.氯离子浓度大小影响氯化银的溶解度.
解答 解:A.将CO2通往入溶有少量氨的BaCl2溶液中,二者不发生反应,所以不会有白色沉淀生成,故A错误;
B.常温下,稀释0.1mol/L的醋酸,稀释过程中氢离子浓度减小,而水的离子积不变,则溶液中氢氧根离子浓度增大,故B错误;
C.等体积等浓度的CH3COOH与NaOH溶液混合后,二者恰好反应生成醋酸钠,由于醋酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),结合电荷守恒可得:c(Na+)>c(CH3COO-),所以溶液中各离子的离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.溶液中氯离子浓度越大,氯化银的溶解度越小,由于相同浓度的氯化钙溶液中氯离子浓度为氯化钠溶液中氯离子浓度的2倍,则AgCl在两溶液中的溶解度不相同,故D错误;
故选C.
点评 本题考查了离子浓度大小比较、难溶物溶度积的应用、弱电解质的电离、离子反应发生条件等知识,题目难度中等,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力,注意掌握电荷守恒、盐的水解原理在判断溶液中各离子浓度大小的应用.

练习册系列答案
相关题目
18.下列关于有机化合物的说法正确的是( )
| A. | 乙醇和乙酸均能与钠反应生成氢气 | |
| B. | 煤的干馏、油脂的皂化和石油的分馏都属于化学变化 | |
| C. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 | |
| D. | 糖类、油脂、蛋白质均属于高分子化合物 |
19.下列有关非金属单质的说法正确的是( )
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
| A. | ①②③⑤⑥ | B. | ②③⑥⑦ | C. | ①②③④⑦ | D. | ①②④⑥ |
16.能证明乙醇分子中含有一个羟基的事实是( )
| A. | 乙醇完全燃烧生成水 | |
| B. | 乙醇容易挥发 | |
| C. | 乙醇能与水以任意比例互溶 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
3.下列反应的离子方程式书写正确的是( )
| A. | Fe3O4溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | Fe3+和CO32-不能共存是因为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向NH4HCO3溶液中加入足量NaOH溶液并加热:NH4++OH-△_△––––––NH3↑+H2O |
13.短周期元素X、Y、Z、W的原子序数依次增大,X、Y、Z的原子序数之和是W的2倍,X、Z在周期表中的相对物质如图所示,X的最低负价绝对值与其原子的最外层电子数相等.下列说法正确的是( )
| X | |||
| Z |
| A. | 离子半径:r(Y)>r(Z)>r(W) | |
| B. | Z的简单离子能破坏水的电离平衡 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z的简单气态氢化物的热稳定性比W的强 |
20.下列说法正确的是( )
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
18.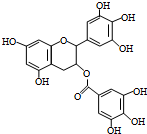 绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
 绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | 1mol EGCG最多可与含9mol NaOH的溶液反应 | |
| C. | EGCG在空气中易被氧化,不能与溴水发生加成反应 | |
| D. | EGCG不能与Na2CO3溶液反应 |



