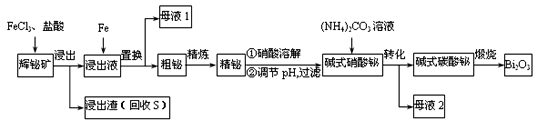
题目内容
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是( )
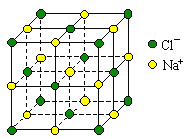
A.1L 1 mol·L-1的醋酸溶液中离子总数为2NA
B.0.05 mol碳酸钠晶体中含离子总数大于0.15NA
C.0.4mol NaCl晶体中含有右图所示的结构单元的数目为0.1NA
D.标准状况下,22.4L CH3Cl和CHCl3的混合物所含有分子数目为NA
【答案】C
【解析】
A. 醋酸是弱电解质,存在电离平衡,1L1molL-1的醋酸溶液中离子总数小于2NA,A项错误;
B. 碳酸钠晶体由钠离子和碳酸根离子构成,0.05mol碳酸钠晶体中含离子总数等于0.05×3×NA=0.15NA,B项错误;
C. 根据均摊法计算,该晶体结构单元中含4个NaCl,所以0.4molNaCl晶体中含有该结构单元的数目为![]() ,C项正确;
,C项正确;
D. 标准状况下,CHCl3不是气体,则22.4LCH3Cl和CHCl3的混合物的物质的量不是1mol,则所含有分子数目不是NA,D项错误;
答案选C。

【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
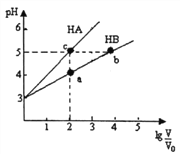
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。