题目内容
12.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如图1: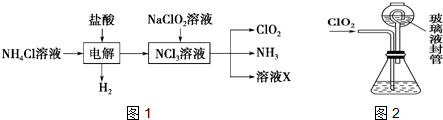
(1)写出电解时发生反应的化学方程式:NH4Cl+2HCl $\frac{\underline{\;通电\;}}{\;}$3H2↑+NCl3.
(2)除去ClO2中的NH3可选用的试剂是C.(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
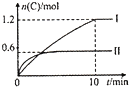
(3)测定ClO2(如图2)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol•L-1 Na2S2O3标准溶液滴定(I2+2Na2S2O3=2NaI+Na2S4O6),共用去V mL Na2S2O3溶液.
①装置中玻璃液封管的作用是吸收残余的二氧化氯气体,并使锥形瓶内外的压强相等.
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式:2ClO2+10I-+8H+═5I2+4H2O+2Cl-.
③滴定终点的现象是溶液恰好由蓝色变为无色且半分钟内溶液颜色不再改变.
④测得通入ClO2的质量m(ClO2)=1.35cV×10-2g.(用含c、V的代数式表示)
分析 氯化铵溶液加入盐酸电解生成NCl3和氢气,溶液中加入NaClO2(亚氯酸钠)反应得到ClO2、NH3和溶液X,
(1)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3;
(2)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体.据此判断;
(3)①用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
②由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
③溶液由无色变为蓝色,且半分钟内不褪去,说明滴定至终点;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
解答 解:(1)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3,其电解反应方程式为:NH4Cl+2HCl $\frac{\underline{\;通电\;}}{\;}$3H2↑+NCl3.
故答案为:NH4Cl+2HCl $\frac{\underline{\;通电\;}}{\;}$3H2↑+NCl3;
(2)A、ClO2易溶于水,不能利用饱和食盐水吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误.
故选:C.
(3)①装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
②由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
③溶液由无色变为蓝色,且半分钟内不褪去,说明滴定至终点,
故答案为:溶液由无色变为蓝色,且半分钟内不褪去,且半分钟内不褪色;
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V•10-3 L×cmol/L=c•V•10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c•V•10-3 mol
所以n(ClO2)=$\frac{1}{5}$c•V•10-3 mol.
所以m(ClO2)=$\frac{1}{5}$c•V•10-3 mol×67.5g/mol=1.35cv×10-2g,
故答案为:1.35cv×10-2.
点评 考查阅读题目获取信息能力、氧化还原反应滴定及应用、对工艺流程及装置理解分析等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.注意基础知识的全面掌握.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.2NA | |
| B. | 1L0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2NA | |
| C. | 7.8gNa2O2中含有的阴离子数目为0.1NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中氢原子数为2NA |
| A. | 2mol/L NaAlO2溶液与5mol/L 的盐酸等体积混合:2AlO2-+5H+═A l(OH)3↓+Al3++H2O | |
| B. | 表示H2SO4与NaOH反应的中和热:H2SO4+2NaOH═Na2SO4 +2H2O,△H=-57.3 kJ•mol-1 | |
| C. | 向Na2SiO3溶液中通入足量的SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| D. | 2KMnO4+HCOOK+KOH═K2MnO4 +O2 ↑+H2O |
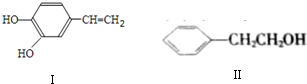
 在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 | 温度 | 起始物质的量 | 热量 | |
| 序号 | A | B | 变化 | |
| I | 600℃ | 1mol | 3mol | 96 kJ |
| n | 800℃ | 0.5mol | 1.5mol | ---- |
| A. | 实验I中,10min内平均速率v(B)=0.06mol.L-1•min-1 | |
| B. | 上述方程式中a=160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验E的平衡体系中再充入0.5molA和1.5molB,A的转化率不变 |
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 该温度下,此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 升高温度,若W的体积分数减小,则此反应△H>0 | |
| C. | 该温度下,再向容器中通入3 mol W,达到平衡时,n(X)=2 mol | |
| D. | 若改为体积可变容器,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
| A. | 制取乙酸乙酯时,先将1体积的酒精倒入3体积的浓硫酸中 | |
| B. | 配置银氨溶液时,将稀氨水滴加到硝酸银溶液中至沉淀恰好溶解为止 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 制硝基苯时,直接把盛有混合液的试管在酒精灯的外焰处加热 |
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别配成溶液,再进行焰色反应 |
 ;
; .
. 医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下: