题目内容
17.在密闭容器中进行X(g)+3Y(g)?2Z(g)的反应,其中X,Y,Z的起始浓度分别是0.1mol/L,0.3mol/L和0.2mol/L,当反应达到平衡时,各物质的浓度有可能是( )| A. | [X]=0.2mol/L,[Y]=0.6mol/L | B. | [Y]=0.5mol/L | ||
| C. | [X]=0.2mol/L,[Z]=0.4mol/L | D. | [Z]=0.4mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X、Y的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X、Y的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X、Y的浓度最小,Z的浓度最大,假定完全反应,则:
X+3Y?2Z
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0 0 0.4
若反应逆正反应进行到达平衡,X、Y的浓度最大,Z的浓度最小,假定完全反应,则:
X+3Y?2Z
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.2 0.6 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X)<0.2,0<c(Y)<0.6,0<c(Z)<0.4,故A、C、D错误,B正确,
故选B.
点评 本题考查了化学平衡的建立,题目难度不大,解题关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
相关题目
8.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 还原性强弱:Cl-<Br-<I- | D. | 碱性强弱:KOH>NaOH>LiOH |
5.已知元素的原子序数,可以推知该元素原子的( )
①中子数 ②质子数 ③核电荷数 ④质量数 ⑤核外电子数.
①中子数 ②质子数 ③核电荷数 ④质量数 ⑤核外电子数.
| A. | ①②③ | B. | ①③⑤ | C. | ②③④ | D. | ②③⑤ |
12.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
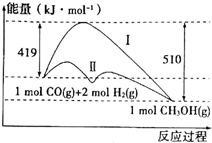 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示. 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: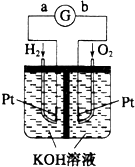 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)