题目内容
8. 按如图所示装置进行实验,并回答下列问题:
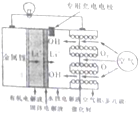
按如图所示装置进行实验,并回答下列问题:(1)判断装置的名称:A池为原电池,B池为电解池.
(2)锌极为负极,电极反应式为Zn-2e-═Zn2+;铜极为正极,电极反应式为Cu2++2e-=Cu;石墨棒C1为阳极,电极反应式为2Cl--2e-═Cl2↑;石墨棒C2附近发生的实验现象为有无色气泡产生附近溶液变红色.
(3)当C2极析出224mL气体(标准状况下)时,锌的质量变化为:减少了0.65g,CuSO4溶液的质量变化为:增加了0.01g.
分析 (1)左边装置能自发的进行氧化还原反应,所以为原电池,右边装置为电解池;
(2)原电池中锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,根据溶液中氢离子浓度变化判断pH变化;
(3)根据串联电路中转移电子相等进行计算.
解答 解:(1)左边装置能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,右边装置有外接电源,属于电解池,故答案为:原电池;电解池;
(2)锌为负极,电极反应式Zn-2e-═Zn2+,铜为正极,铜极上的电极反应式为Cu2++2 e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,石墨棒C2附近还生成氢氧根离子,导致溶液碱性增强,则溶液的pH增大,酚酞遇碱变红色,所以石墨棒C2附近发生的实验现象是:有气体生成、溶液变红色,
故答案为:负;Zn-2e-═Zn2+;正;Cu2++2 e-=Cu;阳;2Cl--2e-=Cl2↑;有无色气泡产生附近溶液变红色;
(3)C2极析出的气体是氢气,氢气的物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,原电池中锌作负极而被腐蚀,所以随着反应的进行,锌的质量逐渐减少,生成0.01mol氢气转移电子的物质的量=0.01mol×2=0.02mol,根据串联电路中转移电子相等知,锌减少的质量=$\frac{0.02mol}{2}$×65g/mol=0.65g,在原电池中,锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,转移0.02mol电子,溶解0.65gZn,析出0.64gCu,溶液质量增加0.01g,
故答案为:减少了0.65 g;增加了0.01g.
点评 本题考查了原电池和电解池原理,根据反应的自发性确定原电池和电解池,再结合各个电极上发生的反应来分析解答,难点是电极反应式的书写,题目难度不大.

| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | CO2、NO2或SO2都会导致酸雨的形成 | |
| C. | 硅是一种灰黑色的金属单质,是现代信息产业的重要元素 | |
| D. | 白磷着火点高且无毒,可用于制造安全火柴 |
| A. | [X]=0.2mol/L,[Y]=0.6mol/L | B. | [Y]=0.5mol/L | ||
| C. | [X]=0.2mol/L,[Z]=0.4mol/L | D. | [Z]=0.4mol/L |
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热都是反应热的种类之一 | |
| D. | 其他条件一样时,氢气与氧气反应生成液态水和气态水时所放出的热量相等 |
| 序号 | 实验装置 | 实验目的 |
| A | 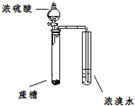 | 证明浓硫酸具有脱水性、氧化性 |
| B | 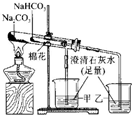 | 比较碳酸钠与碳酸氢钠固体的热稳定性 |
C | 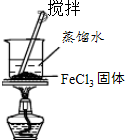 | 制取少量的Fe(OH)3胶体 |
| D | 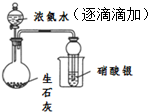 | 证明浓氨水与生石灰作用可制备得到氨气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 盐酸的酸性比氢硫酸(H2S水溶液)酸性强 | |
| B. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS | |
| C. | Cl2能与H2S反应生成S | |
| D. | 还原性:Cl-<S2- |
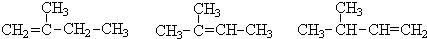
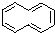 .试回答下列问题
.试回答下列问题