题目内容
7.某短周期元素R,它的最高价氧化物中含氧为60%,它的氢化物中含R为94.12%.R元素原子核内质子数和中子数相等.通过计算求R元素的相对原子质量,并指出它在周期表中的位置.(已知氧元素的相对原子质量为16)分析 设R的相对原子质量为M,最外层电子数为x,则其最高正价为+x,负极为-(8-x),所以它的氢化物的化学式为 H8-xR,最高价氧化物的化学式为R2Ox;根据已知数据计算M,再根据质子数和中子数相等,计算质子数,然后判断元素.
解答 解:设R的相对原子质量为M,最外层电子数为x,则其最高正价为+x,负极为-(8-x),
所以它的氢化物的化学式为 H8-xR,最高价氧化物的化学式为R2Ox;
根据已知数据计算M,再根据质子数和中子数相等,计算质子数,然后判断元素.
它的最高价氧化物中含氧为60%,氢化物中含R为94.12%
则$\frac{16x}{2M+16x}$=60%,
$\frac{M}{M+8-x}$=94.12%,
解得M=32,x=6,
所以R的相对原子质量为32,R中质子数和中子数相等,则其质子数为16,即为S元素,在第三周期第VIA族;
答:R的相对原子质量为32,该元素位于第三周期第VIA族.
点评 本题考查了元素的推断,题目难度不大,注意把握元素最高正价与负极之间的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
15.世界气候大会与2009年在丹麦首都哥本哈根召开,商讨2012年至2020年全球温室气体减排协议.下列物质属于温室气体的是( )
| A. | 可吸入颗粒 | B. | 氮气 | C. | 氧气 | D. | 二氧化碳 |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 16gCH4中含有4NA个C-H键 | |
| B. | 常温常压下,4g氦气所含有的质子数目为4 NA | |
| C. | 18gD2O所含的中子数为10NA | |
| D. | Fe-Cu和硫酸铜溶液构成的原电池中,若生成2g H2,则转移的电子数目为2NA |
12.观察图:对合成氨反应中,下列叙述错误的是( )


| A. | 开始反应时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| C. | 反应到达t1时,正反应速率与逆反应速率相等,反应停止 | |
| D. | 反应在t1之后,正反应速率与逆反应速率相等,反应达到化学平衡状态 |
19.庚烷的分子式是( )
| A. | C5H12 | B. | C6H14 | C. | C7H16 | D. | C10H22 |
16.化学与生产、生活、社会及环境密切相关,下列说法正确的是( )
| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | CO2、NO2或SO2都会导致酸雨的形成 | |
| C. | 硅是一种灰黑色的金属单质,是现代信息产业的重要元素 | |
| D. | 白磷着火点高且无毒,可用于制造安全火柴 |
17.在密闭容器中进行X(g)+3Y(g)?2Z(g)的反应,其中X,Y,Z的起始浓度分别是0.1mol/L,0.3mol/L和0.2mol/L,当反应达到平衡时,各物质的浓度有可能是( )
| A. | [X]=0.2mol/L,[Y]=0.6mol/L | B. | [Y]=0.5mol/L | ||
| C. | [X]=0.2mol/L,[Z]=0.4mol/L | D. | [Z]=0.4mol/L |
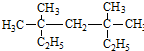 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷;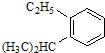 的芳香炔烃的结构简式
的芳香炔烃的结构简式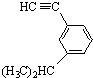 ;
;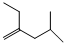 .
.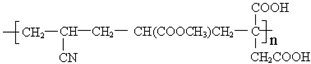
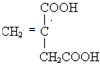 ;
; .
. .
.