题目内容
12.在下列溶液中,各组离子一定能够大量共存的是( )| A. | 使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
分析 A.使酚酞试液变红的溶液,显碱性,铁离子与氢氧根离子反应;
B.四种离子之间不反应,都不与铝离子反应;
C.铁离子与硫氰根离子结合生成硫氰化铁;
D.碳酸氢钠溶液不能存在大量的氢离子.
解答 解:A.使酚酞试液变红的溶液,显碱性,不能大量存在Fe3+,故A错误;
B.Na+、NH4+、SO42-、Cl-之间不反应,都不与反应Al3+,在溶液中能够大量共存,故B正确;
C.Fe3+、SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故C错误;
D.碳酸氢钠溶液与H+反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,题目难度中等,把握习题中的信息及常见离子之间的反应为解答的关键,侧重发生复分解反应的离子共存考查,C为易错点,注意铁离子与硫氰根离子反应.

练习册系列答案
相关题目
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 16gCH4中含有4NA个C-H键 | |
| B. | 常温常压下,4g氦气所含有的质子数目为4 NA | |
| C. | 18gD2O所含的中子数为10NA | |
| D. | Fe-Cu和硫酸铜溶液构成的原电池中,若生成2g H2,则转移的电子数目为2NA |
3.用括号中的试剂除去下列各物质中的少量杂质,其中正确的是 ( )
| A. | 苯中的甲苯(溴水) | B. | 苯中的苯酚(溴水) | ||
| C. | 甲烷中的乙烯(KMnO4酸性溶液) | D. | 溴苯中的溴(NaOH溶液) |
20.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的概念及要求.理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放.以下反应中符合“原子经济性”的是( )
| A. | 乙醇催化氧化制乙醛 | B. | 乙醇与浓硫酸共热制乙烯 | ||
| C. | 乙烷与氯气反应制氯乙烷 | D. | 苯乙烯在一定条件下制聚苯乙烯 |
7.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法不正确的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 化工生产中,可通过改变温度、浓度、压强等因素,提高SO2的转化率 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
17.在密闭容器中进行X(g)+3Y(g)?2Z(g)的反应,其中X,Y,Z的起始浓度分别是0.1mol/L,0.3mol/L和0.2mol/L,当反应达到平衡时,各物质的浓度有可能是( )
| A. | [X]=0.2mol/L,[Y]=0.6mol/L | B. | [Y]=0.5mol/L | ||
| C. | [X]=0.2mol/L,[Z]=0.4mol/L | D. | [Z]=0.4mol/L |
4.图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液.有关说法不正确的是( )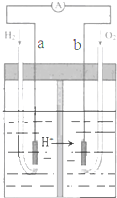

| A. | a极为负极,电子由a极流向b极 | |
| B. | a极的电极反应式是:H2-2e-=2H+ | |
| C. | 电池工作一段时间后,装置中c(H2SO4)增大 | |
| D. | 若将H2改为等物质的量CH4,O2的用量增多 |
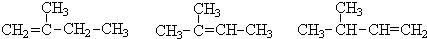
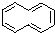 .试回答下列问题
.试回答下列问题