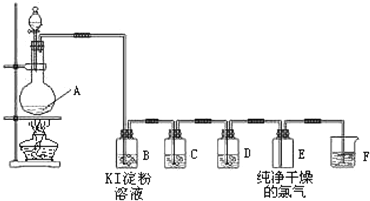
题目内容
2.已知aAn+与dD(n+1)-两种主族元素的单核离子具有相同的电子层结构,则A与D的核电荷数之差是3或5,周期序数之差是1,族序数之差是5或3,A元素位于s区,D元素位于p区.分析 aAn+与dD(n+1)-两种主族元素的单核离子具有相同的电子层结构,则a-n=d+(n-1),且A为金属元素、D为非金属元素,A位于B的下一周期,阳离子电荷数等于主族族序数、阴离子电荷数=8-族序数;如n=3,则A、D分别处于ⅢA族、ⅣA族,ⅣA族元素不可能存在简单阴离子,故A处于ⅠA族或ⅡA族,据此解答.
解答 解:aAn+与dD(n+1)-两种主族元素的单核离子具有相同的电子层结构,则a-n=d+(n+1),则A与D的核电荷数之差(a-d)=2n+1;A为金属元素、D为非金属元素,A位于B的下一周期,二者周期数之差为1,A元素处于nA族,D元素处于[8-(n+1)]A族,二者族序数之差为8-(n+1)-n=7-2n,如n=3,A、D分别处于ⅢA族、ⅣA族,ⅣA族元素不可能存在简单阴离子,故A处于ⅠA族或ⅡA族,即原子序数组成为3或5,族序数之差为5或3,故A处于s区,B处于p区,
故答案为:3或5;1;5或3;s;p.
点评 本题考查结构性质位置关系、元素周期表结构等,注意根据核外电子数相等推断元素周期周期表中的相对位置.

练习册系列答案
相关题目
12.观察图:对合成氨反应中,下列叙述错误的是( )


| A. | 开始反应时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| C. | 反应到达t1时,正反应速率与逆反应速率相等,反应停止 | |
| D. | 反应在t1之后,正反应速率与逆反应速率相等,反应达到化学平衡状态 |
13.下列化合物中,既有离子键,又有共价键的是( )
| A. | NH3 | B. | KOH | C. | CaCl2 | D. | H2O |
17.在密闭容器中进行X(g)+3Y(g)?2Z(g)的反应,其中X,Y,Z的起始浓度分别是0.1mol/L,0.3mol/L和0.2mol/L,当反应达到平衡时,各物质的浓度有可能是( )
| A. | [X]=0.2mol/L,[Y]=0.6mol/L | B. | [Y]=0.5mol/L | ||
| C. | [X]=0.2mol/L,[Z]=0.4mol/L | D. | [Z]=0.4mol/L |
7.下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )
| A. | A是原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A与酸反应置换出的H2比1mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |
14.分子式为C4H10O并能与钠反应放出氢气的有机物同分异构体有x种(不包括立体异构,下同),分子式为C5H10O2并能与NaHCO3溶液反应放出CO2的有机物的同分异构体有y种,则x和y的关系为( )
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
13.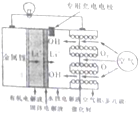 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
14.已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L-1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是( )
| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |