题目内容
9.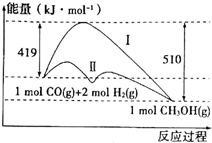 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.该反应是放热(填“吸热”或“放热”)反应.计算当反应生成1.5molCH3OH(g)时,能量变化是136.5kJ.
(2)选择适宜的催化剂不能(填“能”或“不能”)改变该反应的反应热;
(3)推测反应CH3OH(g)?CO(g)+2H2(g)是吸热(填“吸热”或“放热”)反应.
分析 (1)根据反应物与生成物的总能量来分析吸热还是放热,并求出能量变化;
(2)催化剂只能改变反应的途径,不能改变反应的反应热;
(3)该反应的逆反应为吸热反应.
解答 解:(1)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,生成1.5molCH3OH(g)时,能量变化为91 kJ/mol×1.5mol=136.5kJ,
故答案为:放热;136.5kJ;
(2)该反应使用催化剂,只能改变反应的途径降低反应所需的活化能,而不能改变反应热;
故答案为:不能;
(3)该反应的逆反应为吸热反应,
故答案为:吸热.
点评 本题为综合性习题,考查影响化学平衡的因素、热化学反应、化学平衡常数等知识点,注重对高考热点知识的考查,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
19.庚烷的分子式是( )
| A. | C5H12 | B. | C6H14 | C. | C7H16 | D. | C10H22 |
20.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的概念及要求.理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放.以下反应中符合“原子经济性”的是( )
| A. | 乙醇催化氧化制乙醛 | B. | 乙醇与浓硫酸共热制乙烯 | ||
| C. | 乙烷与氯气反应制氯乙烷 | D. | 苯乙烯在一定条件下制聚苯乙烯 |
17.在密闭容器中进行X(g)+3Y(g)?2Z(g)的反应,其中X,Y,Z的起始浓度分别是0.1mol/L,0.3mol/L和0.2mol/L,当反应达到平衡时,各物质的浓度有可能是( )
| A. | [X]=0.2mol/L,[Y]=0.6mol/L | B. | [Y]=0.5mol/L | ||
| C. | [X]=0.2mol/L,[Z]=0.4mol/L | D. | [Z]=0.4mol/L |
14.分子式为C4H10O并能与钠反应放出氢气的有机物同分异构体有x种(不包括立体异构,下同),分子式为C5H10O2并能与NaHCO3溶液反应放出CO2的有机物的同分异构体有y种,则x和y的关系为( )
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
20.下列说法正确的是( )
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热都是反应热的种类之一 | |
| D. | 其他条件一样时,氢气与氧气反应生成液态水和气态水时所放出的热量相等 |
1.下列有关氯化钠的实验中,选用的实验用品都能用到的是( )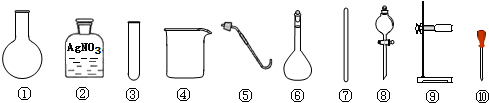

| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
 .试回答下列问题
.试回答下列问题