题目内容
8.含有等物质的量的CH3COOH和CH3COONa的混合溶液中,下列说法正确的是( )| A. | c(CH3COOH)+c(H+ )<c(OH-)+c(CH3COO-) | B. | c(H+ )+c(CH3COOH)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)=c(CH3COOH)+c(CH3COO-) |
分析 醋酸的电离程度大于醋酸根离子的水解程度,则混合液呈酸性:c(H+)>c(OH-)、,根据电荷守恒可知:c(Na+)<c(CH3COO-),则溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);根据物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),则c(CH3COO-)>c(Na+)>c(CH3COOH);溶液中存在电荷守恒:c(Na+)>c(CH3COO-)>c(H+)>c(OH-),据此进行判断.
解答 解:醋酸的电离程度大于醋酸根离子的水解程度,则混合液呈酸性:c(H+)>c(OH-)、,根据电荷守恒可知:c(Na+)>c(CH3COO-),则溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);根据物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),则c(CH3COO-)>c(Na+)>c(CH3COOH),
A.根据分析可知c(Na+)>c(CH3COO-),结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可得:c(CH3COOH)+c(H+ )<c(OH-)+c(CH3COO-),故A正确;
B.根据A可知,c(CH3COOH)+c(H+ )<c(OH-)+c(CH3COO-),故B错误;
C.根据分析可知,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.根据物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确浓度相等时醋酸的电离程度大于醋酸根离子的水解程度为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

| A. | 葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生砖红色沉淀 | |
| B. | 将乙酸铅、硫酸铵溶液分别加入鸡蛋白溶液中,都产生白色沉淀 | |
| C. | 在苯、已烯中加入溴水振荡静置后,溴水层的颜色均变浅或褪去 | |
| D. | 乙酸钠、苯酚钠、乙醇钠溶液均能使酚酞溶液变红 |
| A. | CH2=CH2与CH2=CH-CH=CH2 | B. | CH≡CH与 CH3-CH2-C≡CH | ||
| C. | CH3OH与CH3CH2OH | D. |  与 与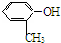 |
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(H+)>c(Cl-)>c(OH-) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| A. | 能发生酯化反应的酸一定是羧酸 | |
| B. | 油脂的水解反应又叫皂化反应 | |
| C. | 天然蛋白质水解的最后产物是多种α-氨基酸 | |
| D. | 淀粉、纤维素、油脂都是高分子化合物 |
