题目内容
20.碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程和实验装置如图1:
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③过滤,步骤⑤萃取分液.
(2)写出步骤④对应反应的离子方程式:Cl2+2I-═I2+2Cl-.
(3)提取碘的过程中,可供选择的有机试剂是CD.
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是分液漏斗、普通漏斗.
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图2实验装置中存在的错误之处:缺石棉网、温度计插到液体中.
分析 (1)分离固体和液体用过滤,将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取;
(2)步骤④对应反应是氯气氧化碘离子为碘单质的反应;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)分液漏斗和普通漏斗的作用分别为萃取和过滤;
(5)烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处.
解答 解:(1)将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法.将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取,故答案为:过滤;萃取分液;
(2)步骤④对应反应是氯气氧化碘离子为碘单质的反应,反应的离子方程式为:Cl2+2I-═I2+2Cl-,
故答案为:Cl2+2I-═I2+2Cl-;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的是四氯化碳或苯,酒精、醋酸溶于水不能分层,
故答案为:CD;
(4)分液漏斗用来萃取,普通漏斗用来过滤,恰好少了这两种玻璃仪器,
故答案为:分液漏斗、普通漏斗;
(5)烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处,
故答案为:缺石棉网、温度计插到液体中.
点评 本题考查制备实验方案的设计,题目难度中等,注意基本实验操作的要点和注意事项,物质性质和提取原理是关键.

练习册系列答案
相关题目
8.含有等物质的量的CH3COOH和CH3COONa的混合溶液中,下列说法正确的是( )
| A. | c(CH3COOH)+c(H+ )<c(OH-)+c(CH3COO-) | B. | c(H+ )+c(CH3COOH)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)=c(CH3COOH)+c(CH3COO-) |
12.已知aX n+和bYm- 两种离子的电子层结构相同,则下列关系成立的是( )
| A. | a=b+n-m | B. | 离子半径Y m-<X n+ | ||
| C. | 原子序数Y>X | D. | 原子半径X>Y |
9.已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11.下列说法正确的是( )
| A. | 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25°C时,Mg(OH)2固体在20mL0.01 mol•L-1氨水中的Ksp比在20mL0.01mol•L-1NH4Cl溶液中的Ksp小 | |
| D. | 25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
10.X、Y、Z、W、R五种短周期元素原子序数依次增大,X原子是最所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料,下列相关说法正确的是( )
| A. | 原子半径按X、Y、Z、R、W的顺序一次增大 | |
| B. | WY2能与强碱溶液反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | W的最高价氧化物对应的水化物难溶于水 |
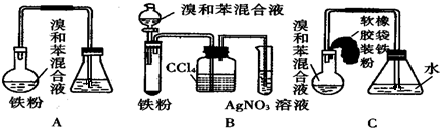
 +Br2
+Br2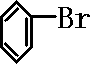 +HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
+HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中. (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),