题目内容
17.有关苯的结构和性质,下列说法正确的是( )| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
分析 A、苯不是单双键交替的结构;
B、苯中不含碳碳双键;
C、苯和溴水发生萃取;
D、苯在浓硫酸做催化剂的条件下,能和浓硝酸发生硝化反应.
解答 解:A、苯不是单双键交替的结构,结构中无碳碳双键,故A错误;
B、苯中不含碳碳双键,不能被高锰酸钾溶液氧化,故B错误;
C、苯和溴水发生萃取而使溴水褪色,而不是化学反应,故C错误;
D、苯在浓硫酸做催化剂的条件下,能和浓硝酸发生硝化反应生成硝基苯,故D正确.
故选D.
点评 本题考查了苯的化学性质和结构,根据苯的结构来理解其性质,难度不大,应注意的是苯和溴水只能萃取,和液溴在溴化铁的催化作用下能发生取代反应.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
8.下表数据是对应物质的熔点,下列说法错误的是( )
| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
2.铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
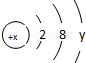
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’). 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).