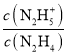题目内容
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
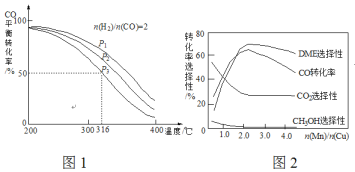
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。
【答案】-246.1 K12·K2·K3 AC 0.003 15 % AB 2.0(2-3之间即可)
【解析】
(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;根据盖斯定律,将已知的热化学方程式叠加,可得到待求的反应的热化学方程式及其反应热;
(2)提高CH3OCH3产率,改变条件应使平衡正向移动,结合平衡移动原理分析解答;
(3)根据物质转化关系,结合平衡时H2的含量,计算反应消耗的H2O、CO的物质的量,然后根据物质反应速率和转化率的含义计算;
(4)A.根据压强一定时,随温度升高CO的转化率减小判断反应的热效应;
B.根据温度不变时CO的转化率遇压强的关系判断几个反应的压强大小;
C.增大氢气的用量,平衡正向移动,CO的转化率增大;
(5)CO的转化率最大,生成二甲醚的选择性最大时最好。
(1)①CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
根据盖斯定律,①×2+②+③得3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=-246.1kJ/mol;该反应是①×2+②+③叠加而来,根据化学平衡常数的含义可知K= K12·K2·K3;
CH3OCH3(g)+CO2(g) △H=-246.1kJ/mol;该反应是①×2+②+③叠加而来,根据化学平衡常数的含义可知K= K12·K2·K3;
(2)A.增大反应物的浓度平衡正移,更多的CH3OCH3生成,能提高CH3OCH3产率,A正确;
B.该反应的正反应为放热反应,升高温度平衡逆向移动,则CH3OCH3产率会降低,B错误;
C.该反应正方向为气体体积减小的方向,所以增大压强平衡正移,能提高CH3OCH3产率,C正确;
故合理选项是AC;
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③CO(g)+H2O(g)![]() CO2(g)+H2(g),5分钟时达到化学平衡,假设反应的CO的物质的量为x,则平衡时各种气体物质的量分别是n(CO)=(0.2-x)mol,n(H2O)=(0.01-x)mol,n(H2)=n(CO2)=xmol,由于该反应是反应前后气体体积相等的反应,所以平衡后混合气体的物质的量n(总)=0.2mol+0.1mol=0.3mol,测得H2的体积分数为0.1,则n(H2)=0.1×(0.2+0.1)mol=0.03mol,则5分钟 时△n(H2O)=△n(CO)=0.03mol,所以v(H2O)=
CO2(g)+H2(g),5分钟时达到化学平衡,假设反应的CO的物质的量为x,则平衡时各种气体物质的量分别是n(CO)=(0.2-x)mol,n(H2O)=(0.01-x)mol,n(H2)=n(CO2)=xmol,由于该反应是反应前后气体体积相等的反应,所以平衡后混合气体的物质的量n(总)=0.2mol+0.1mol=0.3mol,测得H2的体积分数为0.1,则n(H2)=0.1×(0.2+0.1)mol=0.03mol,则5分钟 时△n(H2O)=△n(CO)=0.03mol,所以v(H2O)=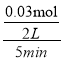 =0.003mol/(Lmin),CO的转化率α(CO)=
=0.003mol/(Lmin),CO的转化率α(CO)=![]() ×100%=15%;
×100%=15%;
(4)A.由图可知,压强一定时,随温度升高CO的转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,A正确;
B.正反应为气体体积减小的反应,增大压强平衡正向移动,CO的转化率增大,所以P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时![]() =3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,C错误;
=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,C错误;
故合理选项是AB;
(5)由图可知当催化剂中![]() 约为2.0时,CO的转化率最大,生成二甲醚的最多。
约为2.0时,CO的转化率最大,生成二甲醚的最多。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出⑧的氢化物和②的氢化物反应的化学方程式________。
(2)在元素①~⑧中,非金属性最强的元素是________(填元素名称)。
(3)写出元素②的最高价氧化物对应水化物的电离方程式________。
(4)写出⑤⑧最高价氧化物的水化物之间的离子反应________________。
(5)由②和⑧组成的化合物中各原子均满足稳定结构,写出该化合物的结构式________________。