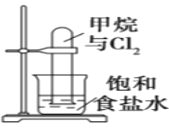
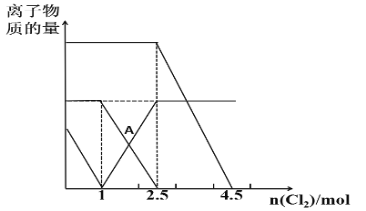
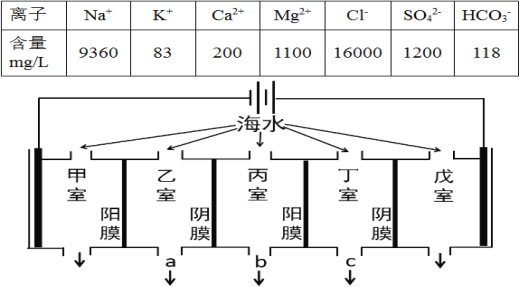
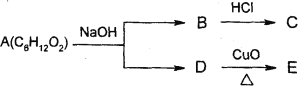
��Ŀ����
����Ŀ����֪����(N2H4)��ˮ�еĵ��뷽��ʽΪN2H4+H2O![]() N2H5++OH-��N2H5++H2O
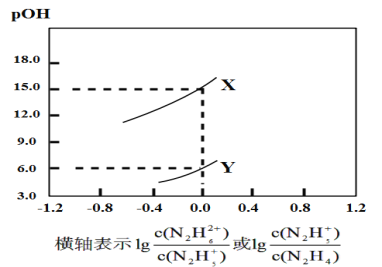
N2H5++OH-��N2H5++H2O![]() N2H62++OH-�������£���������μӵ�������ˮ��Һ�У������Һ��pOH[pOH=-lgc(OH-)]������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ����������������ǣ� ��
N2H62++OH-�������£���������μӵ�������ˮ��Һ�У������Һ��pOH[pOH=-lgc(OH-)]������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ����������������ǣ� ��
A.����X��ʾpOH��lg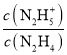 �ı仯��ϵ
�ı仯��ϵ
B.��ӦN2H62++H2O![]() N2H5++H3O+��ƽ�ⳣ��K=10-15
N2H5++H3O+��ƽ�ⳣ��K=10-15
C.��������Һ��ˮϡ��ʱ�����ĵ���̶�������
D.N2H5Cl��ˮ��Һ�д��ڵ�ʽ��c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
���𰸡�AB
��������
N2H4+H2ON2H5++OH-��N2H5++H2ON2H62++OH-����lg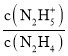 =0ʱ��c(N2H4)=c(N2H5+)��Kb1=
=0ʱ��c(N2H4)=c(N2H5+)��Kb1= =c(OH-)=10-pOH����lg
=c(OH-)=10-pOH����lg =0ʱ��c(N2H5+)=c(N2H62+)��Kb2=
=0ʱ��c(N2H5+)=c(N2H62+)��Kb2= =c(OH-)=10-pOH������Kb1>Kb2����ͼ��֪��X��pOH=15.0��Y��pOH=6.0������Kb1=10-6.0��Kb2=10-15.0������X��ʾpOH��lg
=c(OH-)=10-pOH������Kb1>Kb2����ͼ��֪��X��pOH=15.0��Y��pOH=6.0������Kb1=10-6.0��Kb2=10-15.0������X��ʾpOH��lg �ı仯��ϵ������Y��ʾpOH��lg
�ı仯��ϵ������Y��ʾpOH��lg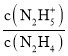 �ı仯��ϵ���ݴ˷������
�ı仯��ϵ���ݴ˷������
A���ɷ�����֪������Y��ʾpOH��lg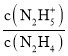 �ı仯��ϵ��A����
�ı仯��ϵ��A����
B����ӦN2H62++H2O![]() N2H5++H3O+��ƽ�ⳣ��Ϊ
N2H5++H3O+��ƽ�ⳣ��Ϊ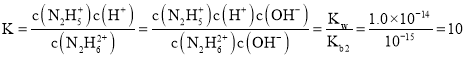 ��B����
��B����
C��ԽϡԽ���룬��������Һ��ˮϡ��ʱ�������ĵ���̶�������C��ȷ��
D��N2H5Cl��ǿ�������Σ�ˮ��Һ�д���N2H5+�ĵ����ˮ�⣬����غ㣺2c(N2H62+)+c(H+)+c(N2H5+)=c(Cl-)+c(OH-)�������غ㣺
c(N2H62+)+c(N2H4)+c(N2H5+)=c(Cl-)�����������غ�͵���غ㣬ˮ��Һ�д��ڵ�ʽ��c(N2H62+)+c(H+)=c(N2H4)+c(OH-)��D��ȷ��
�ʴ�Ϊ��AB��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��I����֪��������H2S��H2CO3�ĵ��볣�����
Ka1 | Ka2 | |
H2S | 9.1��10-8 | 1��10-15 |
H2CO3 | 4.3��10��7 | 5.6��10��11 |
(1)�ٳ����£�0.1 mol��L-1��������Һ��0.1mol��L-1��̼������Һ�����Ը�ǿ����_______����ԭ����_____________________________��
�ڳ����£�����ˮ������ӷ���ʽΪ_____________________________��
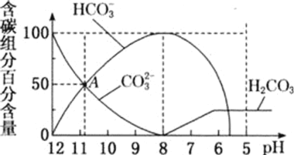
(2)�����£���100mL0.1mol��L��1H2S��Һ�еμ�0.1mol��L��1NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��
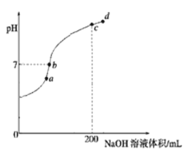
�Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�������________��
II������NO2��SO2��CO���к�����Դ���������Σ����������Ĺ�ͬ��
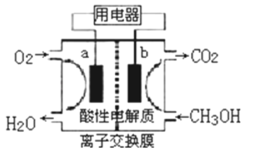
(3)�Լ״���ȼ�ϵĵ�أ���ͼ��ʾ���为����ӦʽΪ________����ȼ�ϵ��������״̬�£�����96.5%�Ļ�ѧ��ת���ɵ��ܣ�������1molҺ��״����ܲ����������ܴ�702.1kJ����ͨ���״�ȼ�յ��Ȼ�ѧ��Ӧ����ʽΪ________��
(4)��֪��NO2(g)+SO2(g)![]() SO3(g)+NO(g) ��H=+41.8kJmol��1��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬��________��
SO3(g)+NO(g) ��H=+41.8kJmol��1��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬��________��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1molSO3��ͬʱ����1molNO2
(5)��������Ӧƽ��ʱ�����NO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=________��