题目内容
【题目】Ⅰ.用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
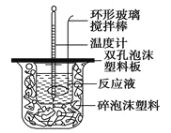
(1)烧杯间填满碎泡沫塑料的作用是______________;
(2)环形玻璃搅拌棒_______(填“能”或“不能”)用环形铁质搅拌棒代替,其原因是________;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:________。
Ⅱ.FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是___________。
【答案】减少实验过程中的热量损失 不能 环形铁质搅拌棒易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低 要保证盐酸反应完全,以盐酸的量为准进行准确计算 不相等 相等 HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=﹣260kJ/mol
【解析】
(1)利用该装置测量中和热,在两个烧杯间填满碎泡沫塑料,目的是减少实验过程中的热量损失;
(2)实验过程中应用环形玻璃搅拌棒而不能同环形铁质搅拌棒,原因是环形铁质搅拌棒易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低;
(3)实验过程中碱应稍过量,原因是要保证盐酸反应完全,以盐酸的量为准进行准确计算;若利用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,反应所放出的热量与上一实验不相等,但经过计算该次实验的中和热与前一实验的中和热相同。
(4)上述反应的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol;
(5)根据盖斯定律,第一个方程式加上第二个方程式的4倍减去第三个方程式的2倍即得到目标方程式,目标方程式的热化学方程式为4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=﹣260kJ/mol。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=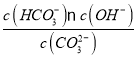 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“span>不变”)。