题目内容
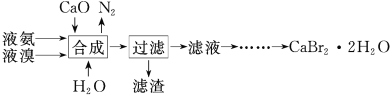
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
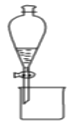
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作(装置如图):
![]()
使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,_______________。
(2)“合成”主要反应的化学方程式为__________________。“合成”温度控制在70℃以下,其原因是_________。投料时控制n(Br2)∶n(NH3)=1∶0.8,其目的是_________________。
(3)“滤渣”的主要成分为____________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,___________________。[实验中须使用的试剂:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱]
【答案】打开玻璃塞,将上层液体从上口倒入另一烧杯中 3CaO+3Br2+2NH3=3CaBr2+N2↑+3H2O 温度过高,Br2、NH3易挥发 使NH3稍过量,确保Br2被充分还原 Ca(OH)2 将滤液蒸发浓缩、冷却结晶、过滤、用乙醇洗涤干净后,在真空干燥箱中干燥(或低温干燥,或用滤纸吸干)
【解析】
制备溴化钙晶体的工艺流程:将液氨、液溴、CaO与水混合发生反应3CaO+3Br2+2NH3=3CaBr2+N2↑+3H2O、CaO+H2O=Ca(OH)2,过滤,滤渣为Ca(OH)2,滤液为CaBr2溶液,呈强碱性,其中含有少量BrO-、BrO3-,加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,得到CaBr22H2O晶体,据此分析作答。
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是:使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,将上层液体从上口倒入另一烧杯中;
(2)在“合成”中为液氨、液溴、CaO发生反应:3CaO+3Br2+2NH3=3CaBr2+N2↑+3H2O;其中液溴、液氨易挥发,所以合成过程温度不能过高;投料时控制n(Br2)∶n(NH3)=1∶0.8,确保Br2被充分还原;
(3)合成反应中:CaO+H2O=Ca(OH)2,故滤渣为Ca(OH)2;
(4)滤液为CaBr2溶液,呈强碱性,其中含有少量BrO-、BrO3-,加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,得到CaBr22H2O晶体。

 阅读快车系列答案
阅读快车系列答案