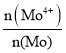题目内容
【题目】氮的化合物在相互转化、工业生产等方面应用广泛,回答下列问题。
(1)N2O是一种能刺激神经使人发笑的气体,可发生分解反应2N2O=2N2+O2,碘蒸气能大幅度提高N2O的分解速率,反应历程为:
第一步: I2(g)=2I(g) (快反应)
第二步: I(g)+N2O(g)=N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)=N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_____(填标号)。
A.温度升高,该反应速率常数k值增大
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2作催化剂,其浓度大小与N2O分解速率无关
(2)温度为T1时,在二个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
容器编号 | 起始浓度/ mol·L-1 | 平衡浓度/ mol·L-1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
Ⅱ | 0.3 | 0.25 | 0.2 | |
①温度为T1时,![]() =________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
=________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
②容器Ⅱ中起始时v正_____v逆(填“>”“<”或“=”),理由是_______。
(3)NH3与CO2反应可合成尿素[化学式为CO(NH2)2],反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比
CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是______。
②在选择氨碳比时,工程师认为控制在4.0左右比较适宜,不选择4.5,理由是_____。
【答案】AC 1.25 < < 因为 Qc=![]() =1.78>K =1.25,反应向逆反应方向进行,所以v正<v逆 0.6~0.7 4.0时CO2转化率已经很高,将氨碳比提高到4.5,CO2转化率提高不大,增加了成本
=1.78>K =1.25,反应向逆反应方向进行,所以v正<v逆 0.6~0.7 4.0时CO2转化率已经很高,将氨碳比提高到4.5,CO2转化率提高不大,增加了成本
【解析】
(1)A.温度升高,反应速率加快;
B.第二步反应为慢反应,对总反应速率起决定性作用;
C.第二步反应为慢反应,第三步反应为快反应,第二步活化能比第三步大;
D.由含碘时N2O分解速率方程式可知;
(2)①Ⅰ容器中平衡时氧气浓度从0.3mol/L变为0.2mol/L,氧气的浓度变化为0.1mol/L,列“三段式”,平衡时v正= v逆,根据v正=k正c2(NO)c(O2)、v逆=k逆c2(NO2)计算![]() ;该反应为放热反应,升高温度平衡向着逆向移动;
;该反应为放热反应,升高温度平衡向着逆向移动;
②容器Ⅱ中,根据Qc与K的相对大小分析平衡移动方向分析解答;
(3)①依据反应转化率的大小分析,结合图象分析判断;
②氨碳比在4.5时氨气量增大对二氧化碳的转化率增加不大。
(1)由分解速率方程可以看出碘单质的浓度也占主要因素,因此碘单质作催化剂,逐项分析可知:
A.温度升高,反应速率加快,k值增大,故A正确;
B.第二步反应为慢反应,对总反应速率起决定性作用,故B错误;
C.第二步反应为慢反应,第三步反应为快反应,第二步活化能比第三步大,故C正确;
D.由含碘时N2O分解速率方程式可知,I2浓度与N2O分解速率有关,故D错误;
故答案为:AC。
(2)①Ⅰ容器中平衡时氧气浓度从0.3mol/L变为0.2mol/L,氧气的浓度变化为0.1mol/L,则
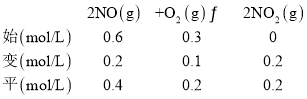
平衡时v正=v逆=,根据v正=k正c2(NO)c(O2)、v逆=k逆c2(NO2)可知:![]() =
=![]() =1.25,反应2NO(g)+O2(g)2NO2(g)△H<0,该反应为放热反应,升高温度平衡向着逆向移动,当温度升高为T2时,k正、k逆分别增大m倍和n倍,则k逆增大幅度较大,即m<n;
=1.25,反应2NO(g)+O2(g)2NO2(g)△H<0,该反应为放热反应,升高温度平衡向着逆向移动,当温度升高为T2时,k正、k逆分别增大m倍和n倍,则k逆增大幅度较大,即m<n;
②容器Ⅱ中,因为Qc=![]() =1.78>K=1.25,反应向逆反应方向进行,所以v正<v逆;
=1.78>K=1.25,反应向逆反应方向进行,所以v正<v逆;
(3)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为0.60.7;
②氨碳比在4.5时,需要氨气较多,但依据图象分析二氧化碳转化率增大不多,工业合成氨生成工艺较复杂,提高生产成本,所以氨碳比控制在4.0左右。

【题目】氨气是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:CO+2H2![]() CH3OH(g)。该可逆反应达到平衡的标志是________。
CH3OH(g)。该可逆反应达到平衡的标志是________。
A.2 v正(H2)= v逆(CH3OH)
B.单位时间生成m molCO的同时生成2m molH2
C.容器内气体的平均相对分子质量不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取化工原料气氢气,某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10min内,CO的物质的量减少的原因可能是____________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容器密闭容器中同时充入0.2molCH4、0.62molH2O、a molCO和0.5molH2,当a =0.2时,上述反应向_____(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为__________。
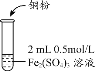
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
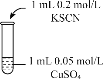
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
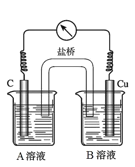
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________