��Ŀ����
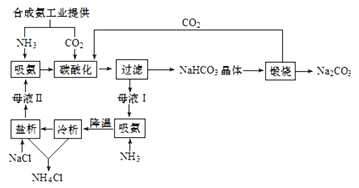
����Ŀ���⣨Mo����һ����Ҫ�Ĺ��ɽ���Ԫ�أ��ڵ�����ҵ�п���ȡ��ʯīϩ���仯���������ƾ��壨Na2MoO42H2O����������ȼ������������ˮϵͳ�Ľ������Ƽ������⾫����Ҫ�ɷ�MoS2��������������Ӧ���ʣ��Ʊ��⼰�����ƾ���Ĺ����������£�

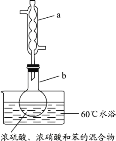
��1������ʱ�����д�ʩ������ʹ�⾫���ַ�Ӧ����________������ţ���
a �����⾫����� b ����ʯ���� c ��������ԭ�����
��2������1��������______��������������з�Ӧ�����ӷ���ʽΪ________��
��3�����������ᾧ�����̿ɵõ������ƾ���Ĵ�Ʒ��Ҫ�õ������������ƾ��壬��Ҫ���еIJ���2������_________��
��4��MoԪ����+4��+6���ּ�̬���⾫���д��ڷ����Ⱦ���MoS2.7����MoS2.7��Mo4+��ռMoԪ�ص����ʵ�������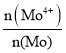 Ϊ__________��
Ϊ__________��
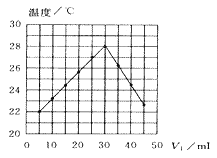
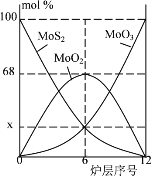
��5�������⾫�����õ�װ���Ƕ�㱺��¯����ͼΪ��¯��������ϵ����ʵ����İٷ���ɡ�ͼ����������x =_____��
��6����ʵ�������л�������SO42�����ɣ��ù���Ba��OH��2��ȥ���ڳ�SO42��ǰ�ⶨ���Һ��c(MoO42��)=0.80mol��L��1�� c(SO42��)=0.04mol��L��1����BaMoO4��ʼ����ʱ��SO42����ȥ����Ϊ94.5������Ksp(BaMoO4)=_________��[ Ksp(BaSO4)= 1.1��10��10����Һ����仯���¶ȱ仯�ɺ��ԡ�]
���𰸡�bc ���� MoO3+CO32-��MoO42-+CO2�� �ؽᾧ 0.3 16 4.0��10��8
��������
�����⾫��MoS2ȼ�գ���Ӧ����ʽΪ2MoS2+7O2![]() 2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2�����������˲�����ȥ����Ӧ�����ʣ���Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ��Ȼ���ؽᾧ�õ�Na2MoO42H2O�������˺����Һ����HCl����Na2MoO4ת��ΪH2MoO4��H2MoO4�����·����ֽ�����MoO3��MoO3�����±�������ԭΪ�����⣬�ݴ˷������������⡣
2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2�����������˲�����ȥ����Ӧ�����ʣ���Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ��Ȼ���ؽᾧ�õ�Na2MoO42H2O�������˺����Һ����HCl����Na2MoO4ת��ΪH2MoO4��H2MoO4�����·����ֽ�����MoO3��MoO3�����±�������ԭΪ�����⣬�ݴ˷������������⡣
(1)����ʱ��ʹ�⾫���ַ�Ӧ�ļ����ԭ�ϵ������ʣ�ʹԭ�Ͼ�����ȫ��ת��������Է���ԭ�ϣ�����ԭ���������ĽӴ�����������Խ����պ��ԭ��ѭ���ٴ����գ��ʴ�ѡbc��
(2)���ݷ���������1�������ǹ��ˣ���ȥ��ʯ�в����뷴Ӧ���������ʣ�������������з�Ӧ�����ӷ���ʽΪMoO3+CO32-=MoO42-+CO2����
(3)�����Ʊ����̷��������������ᾧ�����̿ɵõ������ƾ���Ĵ�Ʒ��Ҫ�õ������������ƾ��壬��Ҫ���еIJ���2�������ؽᾧ��
(4)��MoS2.7�����ʵ���Ϊ1mol������+4��+6���ּ�̬��Mo�����ʵ����ֱ�Ϊxmol��ymol����Mo�����ʵ���Ϊ1mol=xmol+ymol���ٸ���MoS2.7���ϼ�Ϊ�㣬��4x+6y+(-2)��2.7=0���ⷽ����ɵã�x=0.3��y=0.7����MoS2.7��Mo4+��ռMoԪ�ص����ʵ�������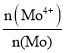 Ϊ
Ϊ![]() =0.3��
=0.3��
(5)�����⾫��Ӧ����ʽΪ2MoS2+7O2![]() 2MoO3+4SO2����ͼ��֪��6���д��ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2��ͼ�����MoO2�����ʵ����ٷֱ�Ϊ68%������MoԪ���غ㣬��MoS2��MoO3�����ʵ����ٷֱȾ�Ϊ16%����xΪ16��
2MoO3+4SO2����ͼ��֪��6���д��ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2��ͼ�����MoO2�����ʵ����ٷֱ�Ϊ68%������MoԪ���غ㣬��MoS2��MoO3�����ʵ����ٷֱȾ�Ϊ16%����xΪ16��
(6)��ʵ�������л�������SO42�����ɣ��ù���Ba(OH)2��ȥ���ڳ�SO42��ǰ�ⶨ���Һ��c(MoO42��)=0.80mol��L��1��c(SO42��)=0.04mol��L��1����BaMoO4��ʼ����ʱ��SO42����ȥ����Ϊ94.5��������Һ��ʣ��c(SO42��)= 0.04mol��L��1��(1-94.5��)=0.0022 mol��L��1��Ksp(BaSO4)= 1.1��10��10= c(SO42��)��c(Ba2+)��c(Ba2+)=![]() =5��10-8 mol��L��1����Ksp(BaMoO4)= c(MoO42��) ��c(Ba2+)=0.80mol��L��1��5��10-8 mol��L��1=4.0��10��8��
=5��10-8 mol��L��1����Ksp(BaMoO4)= c(MoO42��) ��c(Ba2+)=0.80mol��L��1��5��10-8 mol��L��1=4.0��10��8��

 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�����Ŀ�����Ļ��������ת������ҵ�����ȷ���Ӧ�ù㷺���ش��������⡣
(1)N2O��һ���ܴ̼���ʹ�˷�Ц�����壬�ɷ����ֽⷴӦ2N2O=2N2+O2���������ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ���� I2(g)��2I(g) (�췴Ӧ)
�ڶ����� I(g)+N2O(g)��N2(g)+IO(g) (����Ӧ)
�������� IO(g)+N2O(g)��N2(g)+O2(g)+I(g) (�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5(kΪ���ʳ���)�����б�����ȷ����_____(����)��
A���¶����ߣ��÷�Ӧ���ʳ���kֵ����
B�����������ܷ�Ӧ�������������
C���ڶ�����ܱȵ�������
D��I2����������Ũ�ȴ�С��N2O�ֽ�������
(2)�¶�ΪT1ʱ���ڶ����ݻ���Ϊ1L���ܱ������н�������Ӧ��2NO(g)+O2(g)![]() 2NO2(g) ��H��0��ʵ���ã�v��=v(NO)����=2v(O2)����=k��c2(NO)��c(O2)��v��=v(NO2)����=k��c2(NO2)��k����k��Ϊ���ʳ�����
2NO2(g) ��H��0��ʵ���ã�v��=v(NO)����=2v(O2)����=k��c2(NO)��c(O2)��v��=v(NO2)����=k��c2(NO2)��k����k��Ϊ���ʳ�����
������� | ��ʼŨ��/ mol��L��1 | ƽ��Ũ��/ mol��L��1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
�� | 0.6 | 0.3 | 0 | 0.2 |
�� | 0.3 | 0.25 | 0.2 | |
���¶�ΪT1ʱ��![]() =________�����¶�����ΪT2ʱ��k����k���ֱ�����m����n������m______n(������������������=��)��
=________�����¶�����ΪT2ʱ��k����k���ֱ�����m����n������m______n(������������������=��)��
������������ʼʱv��_____v��(������������������=��)��������_______��
(3)NH3��CO2��Ӧ�ɺϳ�����[��ѧʽΪCO(NH2)2]����Ӧ����ʽΪ2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)�ںϳ����н��У���ͼ�Т��������߷ֱ��ʾ�¶�ΪT��ʱ������ͬ��̼��
CO(NH2)2(l)+H2O(g)�ںϳ����н��У���ͼ�Т��������߷ֱ��ʾ�¶�ΪT��ʱ������ͬ��̼��![]() ��ˮ̼��
��ˮ̼��![]() Ͷ��ʱ��������̼ƽ��ת���ʵ������
Ͷ��ʱ��������̼ƽ��ת���ʵ������

�����ߢ���ˮ̼�ȵ���ֵ�ֱ�Ϊ0.6��0.7��1��1.1��1.5��1.6����������Ӧѡ�õ�ˮ̼����ֵ��Χ��______��
����ѡ��̼��ʱ������ʦ��Ϊ������4.0���ұȽ����ˣ���ѡ��4.5��������_____��