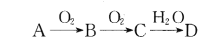题目内容
【题目】新型光催化剂Zn2GeO4具有较高的催化活性。下列有关其组成元素的说法正确的是( )
A.Zn处于元素周期表中的d区
B.Ge的价电子排布式为3d104s24p2
C.基态O原子中成对电子数是未成对电子数的2倍
D.三种元素电负性由大到小的顺序是:O>Ge>Zn
【答案】D
【解析】
A.Zn价电子排布式:3d104s2,所以位于周期表ds区,故A错误;
B.Ge原子核外有32个电子,基态原子的电子排布式为:[Ar]3d104s24p2,则价电子排布为:4s24p2,故B错误;
C.基态O原子轨道表示式为![]() ,成对电子数为3对,未成对电子数为2个,故C错误;
,成对电子数为3对,未成对电子数为2个,故C错误;
D.非金属性越大,元素电负性越大,同周期元素从左到右非金属性依次增强,同主族元素从上到下非金属性依次减弱,所以三种元素电负性由大到小的顺序是:O>Ge>Zn,故D正确;
故选:D。

【题目】氮的化合物在相互转化、工业生产等方面应用广泛,回答下列问题。
(1)N2O是一种能刺激神经使人发笑的气体,可发生分解反应2N2O=2N2+O2,碘蒸气能大幅度提高N2O的分解速率,反应历程为:
第一步: I2(g)=2I(g) (快反应)
第二步: I(g)+N2O(g)=N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)=N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_____(填标号)。
A.温度升高,该反应速率常数k值增大
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2作催化剂,其浓度大小与N2O分解速率无关
(2)温度为T1时,在二个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
容器编号 | 起始浓度/ mol·L-1 | 平衡浓度/ mol·L-1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
Ⅱ | 0.3 | 0.25 | 0.2 | |
①温度为T1时,![]() =________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
=________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
②容器Ⅱ中起始时v正_____v逆(填“>”“<”或“=”),理由是_______。
(3)NH3与CO2反应可合成尿素[化学式为CO(NH2)2],反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比
CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是______。
②在选择氨碳比时,工程师认为控制在4.0左右比较适宜,不选择4.5,理由是_____。