��Ŀ����
����Ŀ������������Ԫ��W��X��Y ��Z��ԭ��������������W��Xͬ���壬Yԭ�ӵ���������������Xԭ�ӵĵ���������Zԭ�ӵĵ�����������W��X��Y����ԭ�ӵĵ�����֮�ͣ�Z������������Ӧˮ����Ļ�ѧʽΪHnZO2n+2��W��X��Y����Ԫ���γɵ�һ�ֻ�����Ľṹ����ͼ��ʾ������˵���������

A.W��������ۺ�����۵Ĵ�����Ϊ0
B.W�ļ����Ӱ뾶���ܴ���X�ļ����Ӱ뾶
C.Y������������Ӧ��ˮ������������
D.Z�ĵ��ʵ�ˮ��Һ�豣������ɫ�Լ�ƿ��
���𰸡�C
��������
����Ϣ��֪W��H��X��Li��Y��Al��Z��ClԪ�ء�
A. HԪ�����Ϊ+1�ۣ����Ϊ-1�ۣ����ߴ�����Ϊ0��A��ȷ��
B. H-��Li+���Ӳ�ṹ��ͬ���˵����Li+>H-���������Ӱ뾶H->Li+��B��ȷ��
C. Y��AlԪ�أ�Al����������Ӧˮ����Al(OH)3�������������C����
D. Cl2����ˮ�õ���ˮ��������ˮ��Ӧ��������ʹ����ᣬ���к��е�HClO���ȶ����������ֽ⣬����Ӧ�ñ�������ɫ�Լ�ƿ�У�D��ȷ��
�ʺ���ѡ����C��

����Ŀ�����Ļ��������ת������ҵ�����ȷ���Ӧ�ù㷺���ش��������⡣
(1)N2O��һ���ܴ̼���ʹ�˷�Ц�����壬�ɷ����ֽⷴӦ2N2O=2N2+O2���������ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ���� I2(g)��2I(g) (�췴Ӧ)
�ڶ����� I(g)+N2O(g)��N2(g)+IO(g) (����Ӧ)
�������� IO(g)+N2O(g)��N2(g)+O2(g)+I(g) (�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5(kΪ���ʳ���)�����б�����ȷ����_____(����)��
A���¶����ߣ��÷�Ӧ���ʳ���kֵ����
B�����������ܷ�Ӧ�������������
C���ڶ�����ܱȵ�������
D��I2����������Ũ�ȴ�С��N2O�ֽ�������
(2)�¶�ΪT1ʱ���ڶ����ݻ���Ϊ1L���ܱ������н�������Ӧ��2NO(g)+O2(g)![]() 2NO2(g) ��H��0��ʵ���ã�v��=v(NO)����=2v(O2)����=k��c2(NO)��c(O2)��v��=v(NO2)����=k��c2(NO2)��k����k��Ϊ���ʳ�����
2NO2(g) ��H��0��ʵ���ã�v��=v(NO)����=2v(O2)����=k��c2(NO)��c(O2)��v��=v(NO2)����=k��c2(NO2)��k����k��Ϊ���ʳ�����
������� | ��ʼŨ��/ mol��L��1 | ƽ��Ũ��/ mol��L��1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
�� | 0.6 | 0.3 | 0 | 0.2 |
�� | 0.3 | 0.25 | 0.2 | |
���¶�ΪT1ʱ��![]() =________�����¶�����ΪT2ʱ��k����k���ֱ�����m����n������m______n(������������������=��)��
=________�����¶�����ΪT2ʱ��k����k���ֱ�����m����n������m______n(������������������=��)��
������������ʼʱv��_____v��(������������������=��)��������_______��
(3)NH3��CO2��Ӧ�ɺϳ�����[��ѧʽΪCO(NH2)2]����Ӧ����ʽΪ2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)�ںϳ����н��У���ͼ�Т��������߷ֱ��ʾ�¶�ΪT��ʱ������ͬ��̼��
CO(NH2)2(l)+H2O(g)�ںϳ����н��У���ͼ�Т��������߷ֱ��ʾ�¶�ΪT��ʱ������ͬ��̼��![]() ��ˮ̼��
��ˮ̼��![]() Ͷ��ʱ��������̼ƽ��ת���ʵ������
Ͷ��ʱ��������̼ƽ��ת���ʵ������

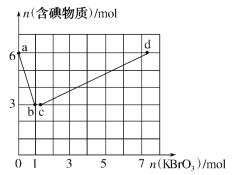
�����ߢ���ˮ̼�ȵ���ֵ�ֱ�Ϊ0.6��0.7��1��1.1��1.5��1.6����������Ӧѡ�õ�ˮ̼����ֵ��Χ��______��
����ѡ��̼��ʱ������ʦ��Ϊ������4.0���ұȽ����ˣ���ѡ��4.5��������_____��
����Ŀ���Ȱ���һ�ֳ�Ч����ˮ����������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)����ҵ�Ͽ�����NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)�Ʊ�һ�Ȱ����ش��������⣺
NH2Cl(g)+HCl(g)�Ʊ�һ�Ȱ����ش��������⣺
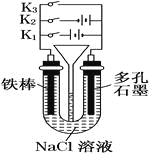
��1���Ȱ�������ˮ����������Ϊˮ�����ɾ���ǿ��ɱ�����õ����ʣ���������___�����Ȱ���ˮ��Ӧ�Ļ�ѧ����ʽΪ___��
��2����֪���ֻ�ѧ���ļ��ܺͻ�ѧ��Ӧ�������仯�������ͼ��ʾ�����Բ�ͬ������ͬ�ֻ�ѧ�����ܵ�ϸ��𣩡�
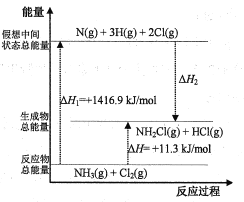
��ѧ�� | N-H | N-Cl | H-Cl |
���ܣ�kJ/mol�� | 391.3 | x | 431.8 |
����H2=___kJ/mol��x=___��
��3�����ܱ������з�ӦNH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)�ﵽƽ�⣬�ݴ˷�Ӧͨ������ѧ���ɼ���������NH2Cl�����������
NH2Cl(g)+HCl(g)�ﵽƽ�⣬�ݴ˷�Ӧͨ������ѧ���ɼ���������NH2Cl�����������![]() �����ȱȣ��ı仯������ͼ��ʾ��
�����ȱȣ��ı仯������ͼ��ʾ��
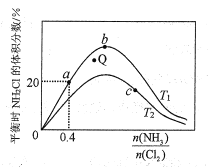
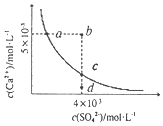
��a��b��c�����Ӧƽ�ⳣ���Ĵ�С��ϵ��___��T1�¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ___���г���ʽ���ɣ���
����T2�¶��£�Q���Ӧ�����ʣ�v��___v��������ڡ���С�ڡ����ڡ�����
���ڰ��ȱ�һ��ʱ�����NH3��ת���ʵķ�����___����д1��)
�������ﶼ�����壬ʵ����NH2Cl���������ʼ�ձ�����ֵ�ͣ�ԭ�������___��