题目内容
13.下列实验能达到预期目的是( )| A. | 用酸式滴定管量取20.0mL酸性高锰酸钾溶液 | |
| B. | 用米汤直接检验食盐中是否有碘元素 | |
| C. | 用酚酞检验纯碱中是否含有烧碱 | |
| D. | 多次盐析或多次渗析的方法分离提纯蛋白质 |
分析 A.酸性滴定管可用来量取酸或强氧化性物质,精确度高;
B.淀粉只能检验单质碘;
C.纯碱溶液呈碱性;
D.根据蛋白质难溶于盐,可盐析以及不能透过半透膜分析.
解答 解:A.酸性滴定管可用来量取酸或强氧化性物质,精确度高,可精确到0.01,故A错误;
B.淀粉只能检验单质碘,食盐中的碘以碘酸钾存在,故B错误;
C.纯碱水解呈碱性,不能确定是否含有NaOH,故C错误;
D.蛋白质难溶于盐,可盐析,属于胶体,不能透过半透膜,故D正确.
故选D.
点评 本题考查化学实验基本操作,题目难度中等,注意把握实验基本方法以及相关物质的性质.

练习册系列答案
相关题目
6.现有三种元素基态原子的电子排布式:①1s22s23p2②1s22s23p3 ③1s22s23p4下列有关比较中正确的是( )
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
1.根据下列实验方案设计,不能测定出相关含量的是( )
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
18.八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方-“达菲”的原材料.莽草酸的结构简式为: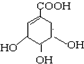 下列关于莽草酸的说法正确的是( )
下列关于莽草酸的说法正确的是( )
 下列关于莽草酸的说法正确的是( )
下列关于莽草酸的说法正确的是( )| A. | 该化合物的分子式为C7H11O5 | |
| B. | 该化合物的分子处于同一平面的原子只有4个 | |
| C. | 该化合物可以与溴水、NaOH、NaHCO3发生反应 | |
| D. | 该化合物在浓硫酸作用下加热不能制备得到 |
5.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
2.下列相关反应的离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
3.下列各组离子,在所给条件下一定能大量共存的( )
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
 cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是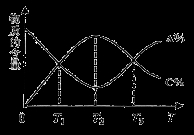
 方向移动
方向移动