题目内容
20.下列操作能达到预期目的是( )| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将乙醇与浓的氢溴酸混合加热可以制备溴乙烷 | |
| D. | 做过银镜反应实验的试管内壁附着银,用稀氨水可以洗去 |
分析 A.应防止生成的AgOH或AgO沉淀影响实验结果;
B.金属作电解池的阴极被保护;
C.乙醇与浓的氢溴酸能发生取代反应;
D.Ag不溶于氨水.
解答 解:A.在碱性条件下水解,应先调节溶液呈酸性,以防止生成的AgOH或AgO沉淀影响实验结果,故A错误;
B.金属作电解池的阴极被保护,则把钢闸门与外加电源的负极连接就可以被保护,故B错误;
C.乙醇与浓的氢溴酸能发生取代反应生成溴乙烷,则将乙醇与浓的氢溴酸混合加热可以制备溴乙烷,故C正确;
D.Ag不溶于氨水,则做过银镜反应实验的试管内壁附着银,不能用稀氨水洗,可以用稀硝酸洗去,故D错误.
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、仪器洗涤、官能团检验、原电池原理等知识点,明确实验原理是解本题关键,注意卤代烃中卤元素检验方法及操作顺序,为易错点.

练习册系列答案
相关题目
13.燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池.下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )
| A. | 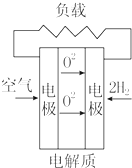 固体氧化物燃料电池 | B. | 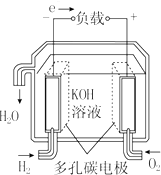 碱性燃料电池 | ||
| C. | 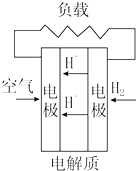 质子交换膜燃料电池 | D. | 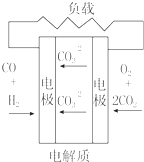 熔融盐燃料电池 |
15.下列说法正确的是( )
| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| B. | Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1mol/L醋酸中c (H+)之比为2:1 | |
| D. | NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
5.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
12.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
A~E中,属于烃的是AB(填字母).
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为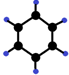 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
A~E中,属于烃的是AB(填字母).
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
10.下列说法不正确的是( )
| A. | 用价层电子对互斥理论预测H2S和BF3的立体结构为:V形和平面三角形 | |
| B. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 |
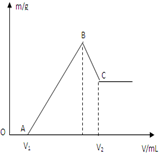 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.