题目内容
16.过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.请回答相关问题:(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
分析 (1)乙基蒽醌作催化剂,氢气和氧气反应生成双氧水;
(2)i.过氧化氢是弱电解质属于二元弱酸分部电离;ii.过氧化氢具有漂白性;
(3)i.实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
ii、由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
(4)i.据氧化还原反应中得失电子守恒和原子守恒配平方程式;
ii.第一次滴定体积和其它三次差距过大,应该舍去,求出第二、三、四三次的平均值,根据反应求出过氧化氢的浓度;
iii.滴定前有气泡,消耗的高锰酸钾偏多,测定结果偏高.
解答 解:(1)通过图示可知,用乙基蒽醌作催化剂制取双氧水,反应为:H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2,
故答案为:H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2;
(2)i.过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为:H2O2?H++HO2- HO2-?H++O22-;
故答案为:H2O2?H++HO2- HO2-?H++O22-;
ii.过氧化氢具有漂白性,能够将pH试纸的红色漂白至百色,所以需用pH计测定其pH,
故答案为:D;
(3)i.实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
ii.由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,即:溶液pH越大,双氧水分解速度越快,
故答案为:溶液pH越大,双氧水分解速度越快;
(4)i.每有1molMnO4-反应得电子5mol,每有1molH2O2反应,失电子2mol,所以高锰酸根和过氧化氢的物质的量之比为2:5,其化学计量数分别为2、5,在据原子守恒,得出锰离子和氧分子前的化学计量数也是2和5,再据电荷守恒配平氢离子为6,据H原子守恒,水的化学计量数为8,化学方程式为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑;
ii.由于第一次数据误差过大,故舍去;其它三组的平均值为 18.00ml,根据反应2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol•L-1×0.018L,c(H2O2)=$\frac{2.5×0.1×0.018}{0.025}$=0.18 mol/L,
故答案为:0.18;
iii.滴定前尖嘴中有气泡,导致消耗的标准液偏大,测定结果偏高,
故答案为:偏高.
点评 本题考查影响化学反应速率因素、化学方程式书写、电离方程式书写等知识,题目难度中等,试题知识点较多、综合性较强,能够较好的考查学生实验设计、数据处理、图象分析的综合能力.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 食盐 | B. | 香醋 | C. | 植物油 | D. | 黄酒 |
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
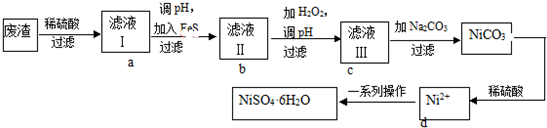
 cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是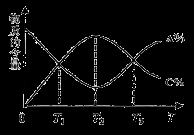
 方向移动
方向移动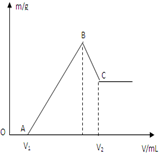 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.