题目内容
10.某原电池总反应的离子方程式为2Fe3++Fe═3 Fe2+,能实现该反应的原电池组成是( )| A. | 正极为铁,负极为铜,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
分析 根据电池反应式知,Fe失电子生成 Fe2+发生氧化反应而作负极,不如Fe活泼的金属或导电的非金属作正极,正极上 Fe3+得电子发生还原反应,所以电解质溶液为可溶性的铁盐溶液,据此分析解答.
解答 解:根据电池反应式知,Fe失电子生成 Fe2+发生氧化反应而作负极,不如Fe活泼的金属或导电的非金属作正极,正极上 Fe3+得电子发生还原反应,所以电解质溶液为可溶性的铁盐溶液,
A.Cu不如铁活泼,则Fe作负极、Cu作正极,故A错误;
B.应该用Fe作负极,不如铁活泼的金属或导电的非金属作正极,石墨是非金属且导电,符合条件,故B正确;
C.锌的活泼性大于Fe,所以不能选取Zn作负极或正极,故C错误;
D.电解质溶液必须是可溶性的铁盐溶液,不能是硫酸铜溶液,故D错误;
故选B.
点评 本题考查原电池设计,会根据电池反应式确定正负极及电解质溶液是解本题关键,失电子的金属作负极、不如负极活泼的金属或导电的非金属作正极,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
1.根据下列实验方案设计,不能测定出相关含量的是( )
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
18.八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方-“达菲”的原材料.莽草酸的结构简式为: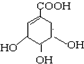 下列关于莽草酸的说法正确的是( )
下列关于莽草酸的说法正确的是( )
 下列关于莽草酸的说法正确的是( )
下列关于莽草酸的说法正确的是( )| A. | 该化合物的分子式为C7H11O5 | |
| B. | 该化合物的分子处于同一平面的原子只有4个 | |
| C. | 该化合物可以与溴水、NaOH、NaHCO3发生反应 | |
| D. | 该化合物在浓硫酸作用下加热不能制备得到 |
5.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
15.下列有关化学用语表示正确的是( )
| A. | 比例模型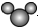 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 | |
| B. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| C. | 离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| D. | 离子方程式HCO3-+H2O?H3O++CO32-可以表示HCO3-离子的水解,也可以表示它的电离 |
2.下列相关反应的离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
19.在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
| A. | 化学反应中物质变化的实质是旧化学键断裂和新化学键形成 | |
| B. | 燃烧可看成“储存”在物质内部的能量转化为热能、光能等释放出来 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是放热反应 |
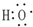 ;
; 容器中,加入X和Y各4mol,一定条件下发生化学反应:
容器中,加入X和Y各4mol,一定条件下发生化学反应: Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是 内平均反应速率υ(Y)= 0.1 mol/( L·s)
内平均反应速率υ(Y)= 0.1 mol/( L·s)