题目内容
5.下列用来解释实验事实的相关平衡方程式不正确的是( )| 实验事实 | 相关平衡方程式 | |
| A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O?HClO+HCl |
| B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH-?Fe(OH)3 |
| C | 溶有CO2的正常雨水pH=5.6 | H2O+CO2?H2CO3?H++HCO3 |
| D | CaCO3固体溶于盐酸 | CaCO3(s)?Ca2+(aq)+CO32(aq) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入NaHCO3与盐酸反应,使Cl2+H2O?HClO+HCl平衡正向移动;
B.配制FeCl3溶液时,应加酸抑制水解;
C.碳酸为二元弱酸,分步电离,以第一步电离;
D.加盐酸,与碳酸根离子反应,促进溶解平衡正向移动.
解答 解:A.加入NaHCO3与盐酸反应,使Cl2+H2O?HClO+HCl平衡正向移动,HClO浓度增大,使氯水的漂白能力增强,故A正确;
B.配制FeCl3溶液时,应加酸抑制水解,发生水解反应为Fe3++3H2O?Fe(OH)3+3H+,故B错误;
C.碳酸为二元弱酸,分步电离,以第一步电离,离子反应为 H2O+CO2?H2CO3?H++HCO3,则正常雨水pH=5.6,故C正确;
D.加盐酸,与碳酸根离子反应,促进CaCO3(s)?Ca2+(aq)+CO32(aq)平衡正向移动,则CaCO3固体溶于盐酸,故D正确;
故选B.
点评 本题考查较综合,涉及离子反应、化学平衡的移动等,注重高频考点的考查,把握发生的离子反应、平衡移动原理的应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
16.能将已烯、已烷、乙醇、乙酸、乙醛、苯酚、硝酸银溶液7种物质鉴别开来的试剂组是( )
| A. | 氯化铁溶液、烧碱溶液、金属钠 | B. | 烧碱溶液、紫色石蕊试液 | ||
| C. | 新制Cu(OH)2悬浊液、紫色石蕊试液 | D. | 新制Cu(OH)2悬浊液、溴水 |
13.Ⅰ.(1)在课本甲烷和氯气的取代反应实验中,向大试管中充入反应气体的方法是通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)x=27.00ml.
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡溶液的体积/mL | 硫酸氢钠溶液的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
20.下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )
| A. | 升高温度 | B. | 用Zn粉代替Zn粒 | ||
| C. | 改用0.1mol/LH2SO4与Zn反应 | D. | 滴加少量的CuSO4溶液 |
3.蛋白质发生下列过程中,可逆的是( )
| A. | 盐析 | B. | 变性 | C. | 煮熟 | D. | 加入酒精 |
4.下列表示物质结构的化学用语或模型正确的是( )
| A. | 中子数为8的碳原子:12C | B. | HF的电子式: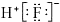 | ||
| C. | Cl-的结构示意图: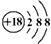 | D. | CH4分子的比例模型: |
 (1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼.请在下面方框中画出电解精炼铜的装置.
(1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼.请在下面方框中画出电解精炼铜的装置.