题目内容
4.甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是Al2O3 写出乙转化为丙的化学方程式:Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4.
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是Fe2O3.写出甲转化乙的离子方程式Fe2O3+6H+=2Fe3++3H2O.
(3)已知(1)中组成甲物质的某元素与(2)中甲物质在引燃剂作用下能发生反应,产生高温,发出强光,则该反应通常称为铝热反应,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
分析 (1)甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,应是两性化合物,则乙为硫酸铝,丙为Al(OH)3,则甲为Al2O3;
(2)若乙溶液中加入KSCN溶液,有血红色出现,应含有Fe3+,则丙为Fe(OH)3,甲为Fe2O3.
(3)铝与氧化铁在高温下发生铝热反应生成Fe与氧化铝.
解答 解:(1)甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,应是两性化合物,则乙为硫酸铝,丙为Al(OH)3,则甲为Al2O3,乙丙转化的化学反应方程式为:Al3Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4,
故答案为:Al2O3;Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4;
(2)若乙溶液中加入KSCN溶液,有血红色出现,应含有Fe3+,则丙为Fe(OH)3,甲为Fe2O3,甲转化为乙的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O;
(3)铝与氧化铁在高温下发生铝热反应生成Fe与氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:铝热反应;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查无机物的推断,本意根据物质的颜色以及转化关系判断,侧重对元素化合物知识的综合应用的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列有关氧化还原反应的叙述正确的是( )
| A. | 氧化剂发生氧化反应 | |
| B. | 当反应中有一种元素被氧化时,一定有另一种元素被还原 | |
| C. | 任何一个置换反应一定属于氧化还原反应 | |
| D. | 氧化还原反应中的反应物,不是氧化剂一定是还原剂 |
9.有关下列图象的说法正确的是( )
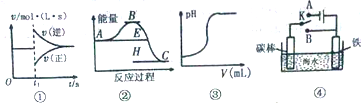

| A. | 图①可以表示,可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0维持温度、压强不变、t1时充入SO3(g) | |
| B. | 根据图②判断,物质A反应生成物C的△H>0 | |
| C. | 图③表示向一定量的氢氧人钠溶液中滴加一定浓度硫酸溶液时的pH变化 | |
| D. | 图④中开关K置于A或B处均可减缓铁的腐蚀 |
16.能将已烯、已烷、乙醇、乙酸、乙醛、苯酚、硝酸银溶液7种物质鉴别开来的试剂组是( )
| A. | 氯化铁溶液、烧碱溶液、金属钠 | B. | 烧碱溶液、紫色石蕊试液 | ||
| C. | 新制Cu(OH)2悬浊液、紫色石蕊试液 | D. | 新制Cu(OH)2悬浊液、溴水 |
13.Ⅰ.(1)在课本甲烷和氯气的取代反应实验中,向大试管中充入反应气体的方法是通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)x=27.00ml.
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡溶液的体积/mL | 硫酸氢钠溶液的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
3.蛋白质发生下列过程中,可逆的是( )
| A. | 盐析 | B. | 变性 | C. | 煮熟 | D. | 加入酒精 |
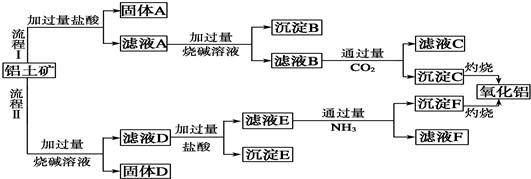
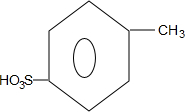 、
、 ;
;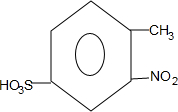 +H2O→
+H2O→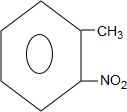 +H2SO4;
+H2SO4;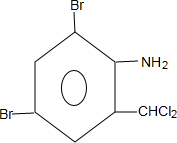 +2NaOH→
+2NaOH→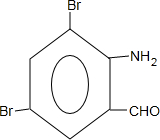 +2NaCl+H2O,写出H发生银镜反应的离子方程式
+2NaCl+H2O,写出H发生银镜反应的离子方程式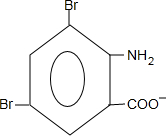 +NH4++2Ag↓+3NH3+H2O.
+NH4++2Ag↓+3NH3+H2O.