��Ŀ����
1���л���X�� ���㷺������ˮ���У�����ƻ�������ѡ����ϡ�ɽ������
���㷺������ˮ���У�����ƻ�������ѡ����ϡ�ɽ��������1����һ���������л���X���ܷ����Ļ�ѧ��Ӧ������D������ĸ��
A��������Ӧ B��ȡ����Ӧ C��������Ӧ D���ӳɷ�Ӧ
��2��д��X������̼�����Ʒ�Ӧ�Ļ�ѧ����ʽHOOCCHOHCH2COOH+2NaHCO3��NaOOCCHOHCH2COONa+2H2O+2CO2����
��3����������X�ֱ����������ƺ��������������Ʒ�Ӧ�������ƺ��������Ƶ����ʵ���֮��Ϊ3��2��
���� �л��ﺬ���Ȼ����������ԣ��ɷ����к͡�������Ӧ�������ǻ����ɷ���ȡ������ȥ��������Ӧ���Դ˽����⣮
��� �⣺��1�����л����к����ǻ����Ȼ������Ծ�������ʹ������ʣ��ܺ��������ȡ����Ӧ���ܺ��������Ʒ����кͷ�Ӧ�����Ӵ��ǻ����ڵ�̼ԭ���Ϻ�����ԭ�ӣ������ܷ�����ȥ��Ӧ��������Ӧ�����ܷ����ӳɷ�Ӧ���ʴ�Ϊ��D��
��2���л��ﺬ���Ȼ�������̼��������Һ��Ӧ������ʽΪHOOCCHOHCH2COOH+2NaHCO3��NaOOCCHOHCH2COONa+2H2O+2CO2����
�ʴ�Ϊ��HOOCCHOHCH2COOH+2NaHCO3��NaOOCCHOHCH2COONa+2H2O+2CO2����
��3�������к���1���ǻ���2���Ȼ����������Ʒ�Ӧ��ֻ���Ȼ���̼�����Ʒ�Ӧ�����������X�ֱ����������ƺ��������������Ʒ�Ӧ�������ƺ��������Ƶ����ʵ���֮��Ϊ3��2��
�ʴ�Ϊ��3��2��
���� ���⿼�����л�������ʡ�ͬ���칹����жϵ�֪ʶ�㣬�ѶȲ������ж��л��ﺬ�еĹ�������ȷ���京�е����ʣ��ṹ�������ʣ�

��ϰ��ϵ�д�
 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�����Ŀ
11�����������������ʵ���Һ����������ԭ���ʹ�����ǣ�������
| A�� | Al2��SO4��3 | B�� | FeCl3 | C�� | Na2CO3 | D�� | KCl |
9���й�����ͼ���˵����ȷ���ǣ�������
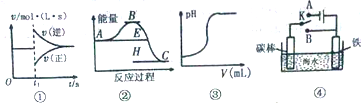

| A�� | ͼ�ٿ��Ա�ʾ�����淴Ӧ2SO2��g��+O2��g��?2SO3��g����H��0ά���¶ȡ�ѹǿ���䡢t1ʱ����SO3��g�� | |
| B�� | ����ͼ���жϣ�����A��Ӧ������C�ġ�H��0 | |
| C�� | ͼ�۱�ʾ��һ����������������Һ�еμ�һ��Ũ��������Һʱ��pH�仯 | |
| D�� | ͼ���п���K����A��B�����ɼ������ĸ�ʴ |
16���ܽ���ϩ�����顢�Ҵ������ᡢ��ȩ�����ӡ���������Һ7�����ʼ��������Լ����ǣ�������
| A�� | �Ȼ�����Һ���ռ���Һ�������� | B�� | �ռ���Һ����ɫʯ����Һ | ||
| C�� | ����Cu��OH��2����Һ����ɫʯ����Һ | D�� | ����Cu��OH��2����Һ����ˮ |
13����1���ڿα������������ȡ����Ӧʵ���У�����Թ��г��뷴Ӧ����ķ�����ͨ���ű���ʳ��ˮ�ķ����Ⱥ��ռ����Թܼ���Ͱ��Թ�������
��2��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=3.8��10 -9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ4��10 -4mo1/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ3.8��10-5mol/L��
�����¶�t���£�ijBa��OH��2��ϡ��Һ��c��H+��=10-amol/L��c��OH-��=10-bmol/L����֪a+b=12�������Һ����μ���pH=b��NaHSO4����û����Һ�IJ���pH���±���ʾ��
��1��x=27.00ml��
��2�������¶��µ�Ba��OH��2��Һȡ��1ml����ˮϡ����1L�����ϡ�ͺ����Һ��c��Ba2+���sc��OH-��=1��20��
��3����NaHSO4��ͬ��NaHSO3 ��NaHCO3ҲΪ��ʽ�Σ���֪NaHSO3��Һ�����ԡ�NaHCO3��Һ�ʼ��ԣ�����Ũ�Ⱦ�Ϊ0.1mol•L-1��NaHSO3��Һ��NaHCO3��Һ����Һ�и����ӵ����ʵ���Ũ�ȴ������й�ϵ��R��ʾS��C�������п�����ȷ����AC������ĸ��
A��c��Na+����c��HRO3-����c��H+����c��RO32-����c��OH-��
B��c��Na+��+c��H+��=c��HRO3-��+c��RO32-��+c��OH-��
C��c��H+��+c��H2RO3��=c��RO32-��+c��OH-��
D������Һ��c��Na+����c��HRO3-����c��RO32-���ֱ���ȣ�
��2��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=3.8��10 -9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ4��10 -4mo1/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ3.8��10-5mol/L��
�����¶�t���£�ijBa��OH��2��ϡ��Һ��c��H+��=10-amol/L��c��OH-��=10-bmol/L����֪a+b=12�������Һ����μ���pH=b��NaHSO4����û����Һ�IJ���pH���±���ʾ��
| ��� | ����������Һ�����/mL | ����������Һ�����/mL | ��Һ��pH |
| �� | 33.00 | 0.00 | 8 |
| �� | 33.00 | x | 7 |
| �� | 33.00 | 33.00 | 6 |
��2�������¶��µ�Ba��OH��2��Һȡ��1ml����ˮϡ����1L�����ϡ�ͺ����Һ��c��Ba2+���sc��OH-��=1��20��
��3����NaHSO4��ͬ��NaHSO3 ��NaHCO3ҲΪ��ʽ�Σ���֪NaHSO3��Һ�����ԡ�NaHCO3��Һ�ʼ��ԣ�����Ũ�Ⱦ�Ϊ0.1mol•L-1��NaHSO3��Һ��NaHCO3��Һ����Һ�и����ӵ����ʵ���Ũ�ȴ������й�ϵ��R��ʾS��C�������п�����ȷ����AC������ĸ��
A��c��Na+����c��HRO3-����c��H+����c��RO32-����c��OH-��
B��c��Na+��+c��H+��=c��HRO3-��+c��RO32-��+c��OH-��
C��c��H+��+c��H2RO3��=c��RO32-��+c��OH-��
D������Һ��c��Na+����c��HRO3-����c��RO32-���ֱ���ȣ�
20������4���л���ķ���ʽ����C4H10O����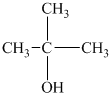 ��
��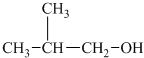 ��
�� ��CH3CH2CH2CH2OH���ܱ������ɺ���̼ͬԭ������ȩ���ǣ�������
��CH3CH2CH2CH2OH���ܱ������ɺ���̼ͬԭ������ȩ���ǣ�������
 ��
��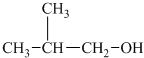 ��
�� ��CH3CH2CH2CH2OH���ܱ������ɺ���̼ͬԭ������ȩ���ǣ�������
��CH3CH2CH2CH2OH���ܱ������ɺ���̼ͬԭ������ȩ���ǣ�������| A�� | �٢� | B�� | ֻ�Т� | C�� | �٢� | D�� | �ڢ� |
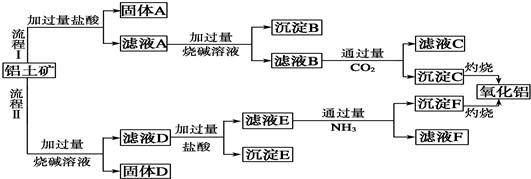
 ��1��ͨ����ұ��������ͭ�Ǵ�ͭ�������ʶ࣬������е�⾫�����������淽���л�����⾫��ͭ��װ�ã�
��1��ͨ����ұ��������ͭ�Ǵ�ͭ�������ʶ࣬������е�⾫�����������淽���л�����⾫��ͭ��װ�ã�