题目内容
7.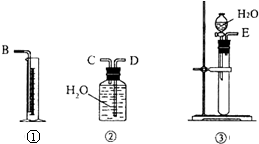 现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.
现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.①所用装置的连接顺序应是(填各接口的字母):E→C→D→B.
②有同学提出,为了控制反应速率,得到平稳的气流,可以用饱和食盐水(填试剂名称)替代装置④中的水.
③若实验时称取的试样为1.40g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为91.4%.
分析 ①测定CaC2试样的纯度,按照③为反应装置、②①为排水法收集装置连接;
②实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
③根据反应方程式计算,体积换算为物质的量,结合化学方程式计算,得到乙炔的质量可解答试样的纯度.
解答 解:①乙炔气体难溶于水可以用排水量气方法测定气体体积,则③为乙炔的生成装置,生成的乙炔从E流出,通过导管C进入广口瓶,把广口瓶中的水由导管D排入量筒,则装置连接顺序为E、C、D、B,
故答案为:C;D;
②CaC2与水反应非常剧烈,生成乙炔的速率较快,为了控制反应速率,得到平稳的气流,实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流,
故答案为:饱和食盐水;
③若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,则乙炔的物质的量为$\frac{V}{V}$=$\frac{0.448L}{22.4L/mol}$=0.02mol,
CaC2+2H2O→Ca(OH)2+C2H2↑
64g 1mol
m 0.02mol
解得m=$\frac{0.02mol×64g}{1mol}$=1.28g
所以纯度为:$\frac{1.28g}{1.40g}$×100%=91.4%,
故答案为:91.4%.
点评 本题考查乙炔的制备方案的设计和物质含量的测定,考查学生的实验设计能力和计算能力,题目难度中等,做题时注意把握实验基本操作知识.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
18.A、B、C三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2:3:6,则A、B、C三种醇分子中羟基数之比是( )
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
15.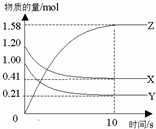 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:2X(g)+2Y(g)?Z(g) |
2.A、B、C、D为短周期元素,在周期表中的相对位置如表所示,且A、B原子序数之和与D的原子序数相等.有关说法正确的是( )
| A | B |
| C | D |
| A. | 原子半径:C>A=D>B | |
| B. | 最高价氧化物对应的水化物酸性:B>D | |
| C. | 气态氢化物的稳定性:C>D>B | |
| D. | C的气态氢化物的水溶液在空气中放置会出现浑浊现象,可以说明非金属性A>C |
12.下列各项表达中正确的是( )
| A. | Na2O2的电子式为 | |
| B. | 原子最外层电子数为2的元素一定位于周期表第ⅡA族 | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为 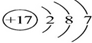 |
19.在下列影响化学反应速率的外界因素中,肯定能增大化学反应速率的是( )
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
| A. | 只有①②④ | B. | 只有②④ | C. | 只有①②③④ | D. | 全部 |
16.原子序数11~17号的元素,随着核电荷数的递增而逐渐变小的是( )
| A. | 电子层数 | B. | 原子半径 | ||
| C. | 原子的最外层电子数 | D. | 元素最高化合价 |
17.某化合物受热可完全分解,其中一种气体可使润湿的红色石蕊试纸变蓝,另一气体可澄清石灰水变浑浊.取该化合物溶于水,加入CaCl2溶液,无现象.则该化合物可能是( )
| A. | NH4HCO3 | B. | NH4Cl | C. | NH4NO3 | D. | (NH4)2CO3 |