题目内容
16.原子序数11~17号的元素,随着核电荷数的递增而逐渐变小的是( )| A. | 电子层数 | B. | 原子半径 | ||
| C. | 原子的最外层电子数 | D. | 元素最高化合价 |
分析 原子序数11~17号的元素,为第三周期元素,电子层数相等,随核电荷数的递增,最外层电子数增大、原子半径逐渐减小,元素最高正化合价增大.
解答 解:原子序数11~17号的元素,为第三周期元素,电子层数相等,随核电荷数的递增,电子层数不变、最外层电子数依次增大、原子半径逐渐减小,元素最高正化合价依次增大,所以随着核电荷数的递增而逐渐变小的是原子半径,
故选B.
点评 本题考查原子结构与元素周期律,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.乙醇在铜做催化剂条件下发生催化氧化时在何处断键( )
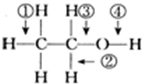

| A. | ① | B. | ② | C. | ③ | D. | ④ |
4.下列装置或操作能达到实验目的是( )
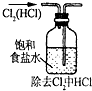
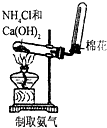
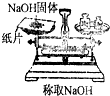
| A. | 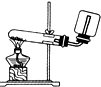 实验室制取并收集NH3 | B. | 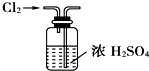 干燥Cl2 | ||
| C. | 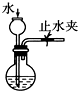 检查装置气密性 | D. |  利用排空气法收集CO2 |
11.在稀硫酸中插一块铜片,再加入下列某一物质后,可使铜片迅速发生反应的是( )
| A. | 硝酸钾晶体 | B. | 硫酸钠晶体 | C. | 氯化钡晶体 | D. | 氯化钠晶体 |
1.元素周期表的一部分,针对表中的①…⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的元素是F,(填元素符号);
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为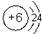 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为
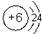 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
5.X、Y、Z是三种气态物质,在一定温度下其变化符合如图所示.下列说法一定正确的是( )
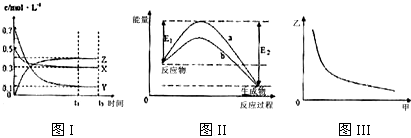

| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
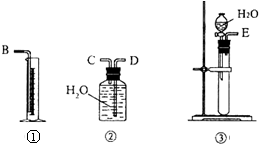 现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.
现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.