题目内容
3.某校老师和学生用相同质量和相同形状的锌片和不同浓度的足量稀盐酸反应得到实验数据如表所示:| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
该反应的离子方程式为:(2)Zn+2H+=Zn2++H2↑.
Ⅱ.实验②和③表明:(3)盐酸浓度越大,化学反应速率越大;
Ⅲ.除上述条件的改变引起速率的改变外,还可能有那些因素加快上述反应速率:
(4)锌的颗粒大小(列举其中一个因素)
Ⅳ.如果把实验③中锌片换成相同质量的铁片,请比较两种金属中那种产生的氢气多并说明原因:
(5)铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
分析 (1)实验①和②中除了温度不同,其它条件完全相同,则探究的是温度对反应速率的影响;
(2)锌与盐酸反应生成氯化锌和氢气,据此写出反应的离子方程式;
(3)实验实验②和③中盐酸的浓度不同,且实验③的浓度较大,收集等体积的氢气消耗时间短;
(4)影响化学反应速率的因素,除温度、浓度外,催化剂及固体颗粒大小也影响化学反应速率;
(5)反应都生成+2价金属离子,金属的摩尔质量越大,等质量时物质的量越小,则生成气体越少.
解答 解:(1)根据实验①和②的数据可知,除温度不同,其它条件完全相同,则实验目的是探究温度对反应速率的影响,
故答案为:温度对反应速率的影响;
(2)锌与盐酸反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(3)实验②和③中盐酸的浓度不同,收集100mL氢气消耗的时间较短,说明盐酸浓度越大,反应速率越快,
故答案为:盐酸浓度越大;
(4)除上述条件的改变引起速率的改变外,锌的颗粒大小也影响化学反应速率,如,锌粒与锌片与相同浓度的盐酸反应时,锌粒的反应速率较快,
故答案为:锌的颗粒大小;
(5)铁的摩尔质量为56g/mol,锌的摩尔质量为65g/mol,根据n=$\frac{m}{M}$可知,相同质量的铁锌,铁的物质的量多,且反应后都生成+2价金属离子,则铁失电子多(每摩尔铁锌均失2mole-),产生的氢气多,
故答案为:铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
点评 本题考查了影响化学反应速率的因素,题目难度中等,明确影响化学反应速率的因素为解答关键,注意掌握探究实验的设计原则,试题知识点较多,充分考查学生的分析能力及化学实验能力.

练习册系列答案
相关题目
11.已知25℃时:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)═BaSO4(s)△H3<0
下列说法正确的是( )
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)═BaSO4(s)△H3<0
下列说法正确的是( )
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
18.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
试回答:①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对双氧水分解反应速率影响的差异
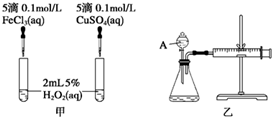
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除阴离子的干扰.
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).
实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂是合理的是B
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
②实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对双氧水分解反应速率影响的差异
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除阴离子的干扰.
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).

实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂是合理的是B
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
8.某反应的化学方程式为:aFeCl2+bKNO3+cHCl═dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为( )
| A. | N2 | B. | NO | C. | NO2 | D. | NH4Cl |
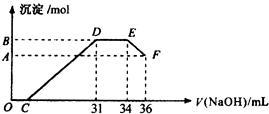 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.