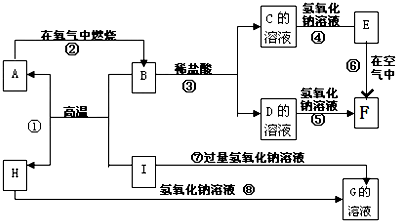
题目内容
5.某混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100mL溶液分别进行下列实验:下列说法正确的是( )| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
分析 ①加入AgNO3溶液,有沉淀产生,溶液中可能含有:Cl-、CO32-、SO42-;
②加入足量NaOH溶液后加热有气体生成,说明溶液中有NH4+,n(NH4+)=n(NH3)=$\frac{0.896L}{22.4L/mol}$=0.04mol;
③加入足量BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而不含Ca2+,据此进行判断.
解答 解:由②加入足量NaOH溶液后加热有气体生成,说明溶液中有NH4+,n(NH4+)=n(NH3)=$\frac{0.896L}{22.4L/mol}$=0.04mol;
由③加入足量的BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而不含 Ca2+;剩余2.33g是BaSO4,n(SO42- )=n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol;
A.由电荷守恒 c(K+)+c(NH4+)=2c(CO32-)+2c(SO42-),可知c(K+)=0.2 mol/L,但是不能确定有没有Cl-,所以c(K+)≥0.2 mol/L,故A正确;
B.加入AgNO3溶液,有沉淀产生,不能说明溶液中有Cl-,因为CO32-、SO42-与AgNO3溶液也能生成沉淀,故B错误;
C.根据A可知,溶液中一定存在钾离子,无法确定是否含有氯离子,故C错误;
D.不能确定溶液中是否含有氯离子,若含有氯离子,则c(K+)+c(NH4+)>2c(CO32-)+2c(SO42-),若不含氯离子,则满足:c(K+)+c(NH4+)=2c(CO32-)+2c(SO42-),故D错误;
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,根据电荷守恒判断钾离子的存在情况为解答关键,也是易错点.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| 现 象 | 解 释 | |
| A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
| A. | C4H10 | B. | C3H8 | C. | C5H12 | D. | C3H7Cl |
| A. | 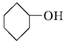 | B. | 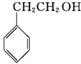 | C. | 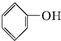 | D. | CH3CH2OH |
 (1)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(1)在两个恒温、恒容的密闭容器中进行下列两个可逆反应: