题目内容
9.将硝酸钠和硝酸钡的混合物进行分离,实验如下:①将NaNO3和Ba(NO3)2的混合物溶于足量的水中配成溶液.
②向混合液里加入过量的Na2CO3溶液,有白色沉淀生成.
③过滤,滤出沉淀并进行洗涤.
④向沉淀中加入硝酸,至沉淀完全溶解后,蒸发溶液得到晶体.
⑤向滤液中加入硝酸,至不再产生气泡为止.
⑥蒸发⑤中所得的溶液,得到晶体.
回答下列问题:
(1)实验②中得到的沉淀是BaCO3,实验④得到的晶体是Ba(NO3)2,实验⑥得到的晶体是NaNO3.
(2)实验②中为什么要加入过量的Na2CO3溶液?
(3)实验⑤中为什么要向滤液中加入硝酸?
(4)写出实验 ②④⑤中反应的化学方程式.
分析 ①将NaNO3和Ba(NO3)2的混合物溶于足量的水中配成溶液.
②向混合液里加入过量的Na2CO3溶液,有白色沉淀生成碳酸钡,此时溶液中溶质为硝酸钠和碳酸钠;
③过滤,滤出沉淀并进行洗涤,得到较纯净的碳酸钡;
④向沉淀中加入硝酸,至沉淀完全溶解后,发生反应BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,蒸发溶液得到晶体Ba(NO3)2;
⑤向滤液中加入硝酸,除去碳酸钠,发生反应Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,至不再产生气泡为止;
⑥蒸发⑤中所得的溶液,得到晶体NaNO3;
结合题目分析解答.
解答 解:①将NaNO3和Ba(NO3)2的混合物溶于足量的水中配成溶液.
②向混合液里加入过量的Na2CO3溶液,有白色沉淀生成BaCO3,此时溶液中溶质为硝酸钠和碳酸钠;
③过滤,滤出沉淀并进行洗涤,得到较纯净的BaCO3;
④向沉淀中加入硝酸,至沉淀完全溶解后,发生反应BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,蒸发溶液得到晶体Ba(NO3)2;
⑤向滤液中加入硝酸,除去碳酸钠,发生反应Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,至不再产生气泡为止;
⑥蒸发⑤中所得的溶液,得到晶体NaNO3;
(1)实验②中得到的沉淀是BaCO3,实验④得到的晶体是Ba(NO3)2,实验⑥得到的晶体是NaNO3,
故答案为:BaCO3; Ba(NO3)2;NaNO3;
(2)为了把钡离子完全转化为碳酸钡沉淀,则加入的碳酸钠应该过量,答:加入过量碳酸钠的目的是把Ba2+全部转化为BaCO3沉淀;
(3)滤液中有剩余的碳酸钠,为了除去碳酸根离子,要加入稀硝酸,答:加入稀硝酸的目的是除去滤液中的CO32-;
(4)②④⑤中反应的化学方程式分别为Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3、BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑、Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,
故答案为:Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3、BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑、Na2CO3+2HNO3=2NaNO3+H2O+CO2↑.
点评 本题考查物质的分离和提纯,为高频考点,明确物质的性质是解本题关键,注意每个步骤发生的反应及操作方法,熟悉实验原理,题目难度不大.

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案| A. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| B. | 28 g CO中所含的原子数为2 NA | |
| C. | 0.1 mol•L-1Na2CO3溶液中,含有CO32-数为0.1 NA | |
| D. | 标准状况下,22.4 L苯的分子数为NA |
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
| A. | 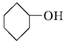 | B. | 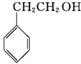 | C. | 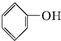 | D. | CH3CH2OH |
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
| A. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Fe3+溶液中滴加过量的氨水:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H20 | |
| D. | NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
②实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对双氧水分解反应速率影响的差异
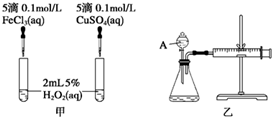
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除阴离子的干扰.
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).
实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂是合理的是B
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
 请按要求回答下列问题:
请按要求回答下列问题: