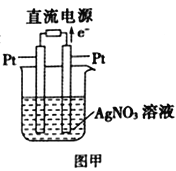
题目内容
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol
NO2(g)═![]() N2O4(g) △H=-28.5kJ/mol
N2O4(g) △H=-28.5kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式_____________。
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=____________;达到平衡时NO2转化率=____________;计算该温度下该反应的化学平衡常数K= _____________(填数值)。
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H
CO(NH2)2(s)+H2O(g) △H
该反应在一定条件下能自发进行的原因是____________;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是_____________(填序号)。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用如图所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95%以HCO3-存在),有利于减少环境中温室气体含量。
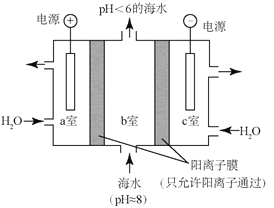
①a室的电极反应式为___________________。
②b室中提取CO2的反应的离子方程式为 ___________________。
③b室排出的海水(pH <6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是___________________。
【答案】 CH4(g) +N2O4(g)=N2(g) +CO2(g) + 2H2O(g) △H=-810.0kJ/mol 0.075 mol/ (L·s) 0.75 1.8 △H<0 bd 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O) H++HCO3-=H2O +CO2↑ 用c室排出的碱性溶液将从b室排出的酸性海水调节至接近正常海水的pH
【解析】(1)已知:①CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol,②NO2(g)═![]() N2O4(g) △H=-28.5kJ/mol,根据盖斯定律可知①-②即可得到CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式为CH4(g) +N2O4(g)=N2(g) +CO2(g) + 2H2O(g) △H=-810.0kJ/mol;(2)
N2O4(g) △H=-28.5kJ/mol,根据盖斯定律可知①-②即可得到CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式为CH4(g) +N2O4(g)=N2(g) +CO2(g) + 2H2O(g) △H=-810.0kJ/mol;(2)
NO2(g)+SO2(g)═SO3(g)+NO(g)
起始浓度(mol/L) 1 2 0 0
变化浓度(mol/L) 0.75 0.75 0.75 0.75
平衡浓度(mol/L) 0.25 1.25 0.75 0.75
则10s内反应的平均速率v(SO2)=0.75mol/L÷10s=0.075 mol/ (L·s);达到平衡时NO2转化率=0.75/1×100%=75%;计算该温度下该反应的化学平衡常数K=![]() =1.8。(3)正反应是熵值减小的可逆反应,根据△G=△H-T·△S<0可知该反应在一定条件下能自发进行的原因是△H<0。a.CO2与H2O(g)浓度相等不能说明中逆反应速率,反应不一定处于平衡状态,a错误;b.正反应体积减小,则容器中气体的压强不再改变说明反应达到平衡状态,b正确;C.2v(NH3)正=v(H2O)逆不满足反应速率之比是相应的化学计量数之比,因此反应没有处于平衡状态,c错误;d.容器容积不变,混合气体的质量变化,所以容器中混合气体的密度不再改变说明反应达到平衡状态,d正确,答案选bd。(4)①a室为阳极,发生氧化反应,电极方程式为4OH--4e-=O2↑+2H2O;②c室发生2H2O+2e-=2OH-+H2↑,可用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,以达到排放标准。
=1.8。(3)正反应是熵值减小的可逆反应,根据△G=△H-T·△S<0可知该反应在一定条件下能自发进行的原因是△H<0。a.CO2与H2O(g)浓度相等不能说明中逆反应速率,反应不一定处于平衡状态,a错误;b.正反应体积减小,则容器中气体的压强不再改变说明反应达到平衡状态,b正确;C.2v(NH3)正=v(H2O)逆不满足反应速率之比是相应的化学计量数之比,因此反应没有处于平衡状态,c错误;d.容器容积不变,混合气体的质量变化,所以容器中混合气体的密度不再改变说明反应达到平衡状态,d正确,答案选bd。(4)①a室为阳极,发生氧化反应,电极方程式为4OH--4e-=O2↑+2H2O;②c室发生2H2O+2e-=2OH-+H2↑,可用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,以达到排放标准。

【题目】已知硫酸、氨水的密度与所加水量的关系如图所示:
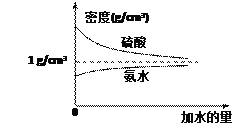
现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
⑴ ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
⑵ 表中2 mol·L-1氨水的质量分数为:________。
⑶ 将4 mol·L-1的氨水与2 mol·L-1的氨水等质量混合,所得氨水的物质的量浓度是_____(填序号)。
A.>3 mol·L-1 B.=3 mol·L-1 C.<3 mol·L-1 D.无法判断
⑷ 将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______(填序号)。
A.>15% B.=15% C.<15% D.无法判断
⑸ 100g浓度为4 mol·L-1的硫酸溶液与_________mL水混合,能使硫酸的物质的量浓度减小到2 mol·L-1。