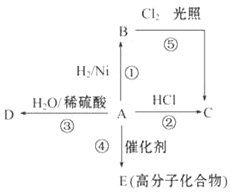
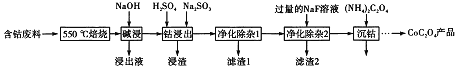
题目内容
【题目】下列粒子半径大小的比较正确的是( )
A. Al 3+<O2- B. Cl->Br-
C. Mg<Al D. K<Na
【答案】A
【解析】A、Al 3+、O2-两种微粒都是两个电子层,核电荷数越多,半径越小,所以粒子半径Al 3+<O2-,故A正确;B、. Cl-三个电子层,Br-是四个电子层,电子层越多,半径越大, ,所以离子半径: Cl<<Br-,所以B选项是错误的;C、电子层一样,核电荷数越多,半径越小,所以Mg>Al ,故C错误;D、电子层越多,半径越大,所以K>Na,故D错误。所以B选项是正确的。

练习册系列答案
相关题目