题目内容
【题目】(1)常温下,0.5 mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3 kJ。写 出甲醇燃烧的热化学方程式________________________________。
(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,则加入下列物质中的__________(填序号)物质能使溶液恢复成原来浓度;
A.CuO B.Cu(OH)2 C.Cu D. H2O
电解后电解质溶液的PH值__________________(填“增大”“减小”或“不变”);写出电解总离子方程式________________________________。
(3)用Pt作电极电解硝酸银溶液,如图甲所示,则左边Ft电极名称是________________;发生的电极反应式为___________________。

(4)甲烷—氧气燃料电池:电解质溶液为强碱溶液,Pt作电极,在电极上分别通入甲烷和氧气。通入氧气的电极应为_______极_(填“正”或“负”),该电极上发生的电极反应式为__________________。
【答案】 CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O(l) △H=-726.6kJ·mol-1 A 减小 Cu2++2H2O![]() O2+4H++2Cu 阴极 Ag++e-=Ag 正 2H2O+O2+4e-=4OH-
O2+4H++2Cu 阴极 Ag++e-=Ag 正 2H2O+O2+4e-=4OH-
【解析】(1)常温下,0.5 mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3 kJ。则1mol甲醇完全燃烧放热是726.6kJ,因此甲醇燃烧的热化学方程式为CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O(l) △H=-726.6kJ·mol-1。(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,产生阳极产生氧气,阴极析出铜,所以加入氧化铜能使溶液恢复成原来浓度,答案选A。电解后有硫酸生成,因此电解质溶液的pH值减小,电解总离子方程式为Cu2++2H2O![]() O2↑+4H++2Cu。(3)根据电子的流向可知右侧电极是阳极,因此左边Pt电极名称是阴极,银离子放电,发生的电极反应式为Ag++e-=Ag。(4)氧气得到电子,则通入氧气的电极应为正极,该电极上发生的电极反应式为2H2O+O2+4e-=4OH-。
O2↑+4H++2Cu。(3)根据电子的流向可知右侧电极是阳极,因此左边Pt电极名称是阴极,银离子放电,发生的电极反应式为Ag++e-=Ag。(4)氧气得到电子,则通入氧气的电极应为正极,该电极上发生的电极反应式为2H2O+O2+4e-=4OH-。

【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
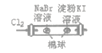
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D