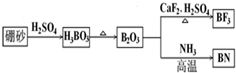
题目内容
4.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+.
(3)①和⑨两元素形成的化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,
(1)同周期自左而右非金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(2)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小;
(3)溴化钠与氯气反应生成氯化钠与溴.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,
(1)同周期自左而右非金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,则KOH的碱性最强,
故答案为:KOH;
(2)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+,
故答案为:Cl->K+>Mg2+;
(3)溴化钠与氯气反应生成氯化钠与溴,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
点评 本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期律的结构,侧重对基础知识的巩固.

练习册系列答案
相关题目
19.下列反应中,既属于离子反应,又属于有颜色变化的氧化还原反应的是( )
| A. | FeCl3溶液和KSCN溶液混合 | B. | 锌放入稀硫酸中 | ||
| C. | 铜片放入氯化铁溶液中 | D. | 硫酸铜溶液与氢氧化钠溶液混合 |
10.下列各原子或离子的电子排布式错误的是( )
| A. | Ca2+ 1s22s22p63s23p6 | B. | O2-1s22s23p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar 1s22s22p63s23p6 |
11.如图实验不能达到目的是( )
| A. | 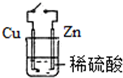 原电池能加快反应速率 | B. | 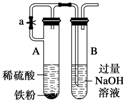 制备Fe(OH)2 | ||
| C. | 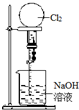 喷泉实验 | D. | 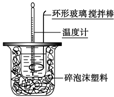 中和热的测定 |
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
 中的______________、_____________(填字母编号)。
中的______________、_____________(填字母编号)。 N2O4(g)。
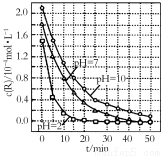
N2O4(g)。 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快. ;
;
 强,R的降解速率越小
强,R的降解速率越小