题目内容
11.如图实验不能达到目的是( )| A. | 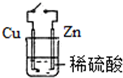 原电池能加快反应速率 | B. | 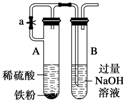 制备Fe(OH)2 | ||
| C. | 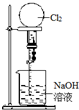 喷泉实验 | D. | 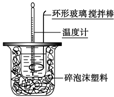 中和热的测定 |
分析 A.原电池能将化学能转化为电能,原电池能加快反应速率;
B.稀硫酸和Fe反应生成氢气能排出空气,防止氢氧化亚铁被氧化,但硫酸亚铁和氢氧化钠不能接触;
C.该气体极易溶于该溶液时就能发生喷泉实验;
D.中和热测定时,用环形玻璃搅拌棒进行搅拌,用碎泡沫塑料保温.
解答 解:A.该装置符合原电池构成条件,所以能形成原电池,原电池因为能直接转化为电能而加快反应速率,故A正确;
B.稀硫酸和Fe反应生成氢气能排出空气,防止氢氧化亚铁被氧化,但硫酸亚铁和氢氧化钠不能接触,所以不能制取氢氧化亚铁,故B错误;
C.氯气和氢氧化钠反应生成可溶性的钠盐,所以氯气极易溶于氢氧化钠溶液,能形成压强差而形成喷泉实验,故C正确;
D.根据量热计的构造,该装置类似于量热计的结构,可以进行中和反应反应热的测定,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及基本操作即可解答,注意从实验操作规范性及物质性质分析评价,题目难度不大.

练习册系列答案
相关题目
4.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)①②⑤中,最高价氧化物对应水化物,碱性最强的是KOH.
(2)②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+.
(3)①和⑨两元素形成的化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+.
(3)①和⑨两元素形成的化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
2.普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
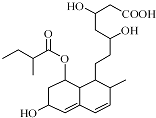

| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 不能发生加成、取代、消去反应 | |
| D. | 1mol 该物质最多可与3mol NaOH 反应 |
19.在稀硫酸酸化的H2O2溶液中加入乙醚(C2H5-O-C2H5)后,溶液分层,再加入少量K2Cr2O7溶液,并振荡,在乙醚层中出现深蓝色,这是因为生成2CrO5•(C2H5)2O所致,其反应方程式为:Cr2O72-+4H2O2+2H+═2CrO5+5H2O,已知:CrO5的结构式为: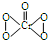 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | Cr2O72- 被氧化成CrO5 | |
| B. | 该反应为氧化还原反应 | |
| C. | 反应中H2O2被还原成H2O | |
| D. | 此反应用于检验Cr2O72-离子的存在 |
16.一块质量为4g的合金,与足量的盐酸反应完全后生成氢气0.2g,则该合金可能是( )
| A. | 铁镁合金 | B. | 铁铜合金 | C. | 铁锌合金 | D. | 镁铝合金 |
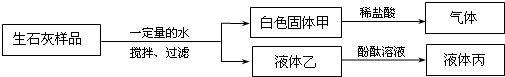
3.为了探究实验室中久置的生石灰样品变质情况,同学们进行如图所示的实验.下列分析和结论不正确的是
( )
( )

| A. | 该样品已完全变质 | |
| B. | 液体丙呈红色或无色 | |
| C. | 该样品中一定含有碳酸钙 | |
| D. | 白色固体甲可能为Ca(OH)2和CaCO3的混合物 |
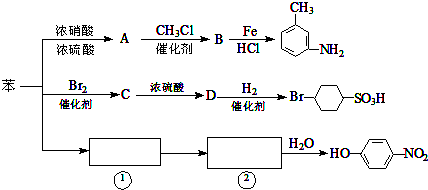
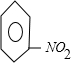 +CH3Cl$\stackrel{催化剂}{→}$
+CH3Cl$\stackrel{催化剂}{→}$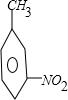 +HCl.
+HCl. ,②
,② 或
或 .
.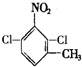 、
、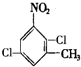
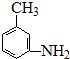 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.