题目内容
9.下列化学过程及其表述正确的是( )| A. | 新制氢氧化铜和乙醛反应的离子方程式:CH3CHO+2Cu(OH)2+OH- $→_{加热}^{水浴}$ CH3COO-+Cu2O↓+3H2O | |
| B. | 苯酚与碳酸钠溶液反应:C6H5OH+CO32-→C6H5O-+HCO3- | |
| C. | 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol | |
| D. | 可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性: 2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.新制氢氧化铜和乙醛反应生成乙酸、氧化亚铜和水;
B.苯酚与碳酸钠反应生成苯酚钠和碳酸氢钠;
C.1mol KAl(SO4)2含有1molAl3+、2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,由方程式可知当加入1.5molBa(OH)2时,Al3+完全沉淀,SO42-反应1.5mol,SO42-有剩余,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4,由方程式可知加入1molBa(OH)2,溶解2molA1(OH)3,生成1molBaSO4,沉淀的物质的量减少,但是沉淀的质量增加,当硫酸根离子全部转化为硫酸钡沉淀时,沉淀质量最大;
D.高锰酸钾具有强的氧化性,能够氧化氯离子.
解答 解:A.新制氢氧化铜和乙醛反应生成乙酸、氧化亚铜和水,离子方程式:CH3CHO+2Cu(OH)2$→_{加热}^{水浴}$ CH3COOH+Cu2O↓+2H2O,故A错误;
B.苯酚与碳酸钠溶液反应,离子方程式:C6H5OH+CO32-→C6H5O-+HCO3-,故B正确;
C.向含有1 mol KAl(SO4)2的溶液中加入1.5molBa(OH)2时,先生成硫酸钡沉淀和氢氧化铝沉淀,在加入0.5mol氢氧化钡沉淀时,继续生成硫酸钡沉淀,氢氧化铝恰好溶解,沉淀的物质的量虽然减少,但是沉淀的总质量增加,所以当加入氢氧化钡的物质的量为1.5+0.5=2mol,生成2mol硫酸钡沉淀,此时沉淀质量最大,故C正确;
D.浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故D错误;
故选:BC.
点评 本题考查了离子方程式的书写,明确发生反应的实质及离子方程式书写的方法是解题关键,注意反应物用量对反应的影响,题目难度中等.

 名校课堂系列答案
名校课堂系列答案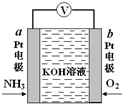 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | O2在电极b上发生还原反应 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2↑+6H2O |
| A. | 硅酸凝胶经干燥脱水后得到“硅胶”,常用作干燥剂,也可以用作催化剂的载体 | |
| B. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| C. | 煤与氢气作用生成液体燃料,也可以间接液化,先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇 | |
| D. | 含氮和磷的大量污水任意排放向近海海域会出现水华、赤潮等污染问题 |
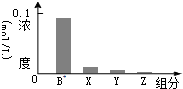 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液显中性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |

| A. | 脱硫反应△H<0 | |
| B. | n(NH3)/n(SO2):a<b<c | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | 及时从体系中除去水,平衡常数增大 |
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |
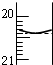 氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:
氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是: